
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关
B. H2O的熔、沸点高于H2S是由于H2O分子间存在氢键
C. 甲烷可与水形成氢键
D. 白酒中,乙醇分子和水分子间存在范德华力和氢键
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中不正确的是( )
A.标准状况下,1 g H2和14 g N2的体积相同
B.1 mol氧含6.02×1023个O2分子
C.将15.6gNa2O2固体加入到足量水中,反应过程中转移电子总数为1.204×1023个
D.20g重水(D2O)中含有电子数为6.02×1024个
查看答案和解析>>
科目: 来源: 题型:
【题目】NOx的排放主要来自于汽车尾气,包含 NO2 和 NO I.
(1)用 CH4 催化还原 NOx 可以消除氮氧化物的污染。例如:
a.CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) H1= -574kJ/mol
b.CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) H2= -1160kJ/mol
①这两个反应在热力学上趋势均很大,其原因是:______________。
②有利于提高 NOx 的平衡转化率的反应条件是:______________(至少答一条)。
③在相同条件下,CH4(g)+2NO2(g)=N2(g)+2H2O(g)+CO2(g) H2=______________kJ/mol
(2)为了提高 CH4 和 NO 转化为 N2 的产率,种学家寻找了一种新型的催化剂。将 CH4 和 NO 按一定比例、一定流速通过装有上述新型催化剂的反应器中,测得 N2 的产率与温度的关系如图1所示,OA 段 N2 产率增大的原因是______________。 AB 段 N2 产率降低的可能原因是______________(填标号)
A. 催化剂活性降低 B. 平衡常数变大 C. 副反应增多
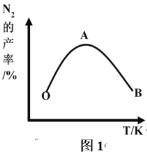
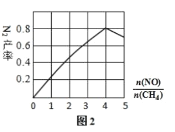
(3)N2 的产率与![]() ,由图可知
,由图可知![]() 最佳约为____________
最佳约为____________
II.有人利用反应 2C(s)+2NO2(g) ![]() N2(g)+2CO2(g) ΔH=-64.2kJ/mol 对 NO2 进行吸附。在 T℃下,向密闭容器中加入足量的 C 和一定量的 NO2 气体,图为不同压强下上述反应经过 相同时间,NO2的转化率随着压强变化的示意图。
N2(g)+2CO2(g) ΔH=-64.2kJ/mol 对 NO2 进行吸附。在 T℃下,向密闭容器中加入足量的 C 和一定量的 NO2 气体,图为不同压强下上述反应经过 相同时间,NO2的转化率随着压强变化的示意图。
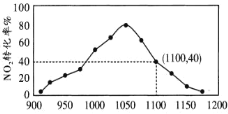
用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作 Kp);在 T℃、 1100KPa 时,该反应的化学平衡常数 Kp=______________ (计算表达式表示); 已知:气体分压(P 分)=气体总压(P 总)×体积分数。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、Q、R 是周期表中前 36 号元素,核电荷数依次增大,其中 X、Y、Z、 W 都是元素周期表中短周期元素。X 为非金属元素,且 X 原子的核外成对电子数是未成对电子数的 2 倍,Z 的次外层电子数是最外层电子数的![]() ,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。 回答下列问题:
,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。 回答下列问题:
(1)X的最高价氧化物对应的水化物分子中,中心原子采取______________杂化。
(2)化合物 XZ 与 Y 的单质分子互为______________,1mol XZ 中含有π键的数目为______________。
(3)W 的稳定离子核外有______________种运动状态的电子。W元素的第一电离能比其同周期 相邻元素的第一电离能高,其原因是:_____。
(4)Q 的晶体结构如图所示,则在单位晶胞中 Q 原子的个数为______________,晶体的配位数是______________。

(5)R元素的基态原子的核外电子排布式为________;Y 与 R 形成某 种化合物的晶胞结构如图所示,已知该晶体的密度为ρg·cm-3,阿伏加德罗常数的数值为 NA,则该晶体中 R 原子和 Y 原子之间的最短距离为______________cm。(只写计算式)
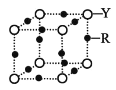
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常用的发色剂和防腐剂,某学习小组利用如图装置(夹持装置略去)制取亚硝酸钠,已知:2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3;NO能被酸性高锰酸钾氧化为NO3-。下列说法正确的是( )
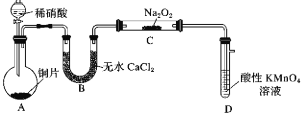
A.可将B中的药品换为浓硫酸
B.实验开始前通一段时间CO2,可制得比较纯净的NaNO2
C.开始滴加稀硝酸时,A中会有少量红棕色气体
D.装置D中溶液完全褪色后再停止滴加稀硝酸
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. SiO2硬度大的原因与Si、O原子之间的成键方式及排列方式有关
B. 乙醇沸点高于二甲醚的原因与分子间作用力大小有关
C. 冰醋酸溶于水时只破坏分子间作用力
D. MgO熔点高达![]() 是因为其中的离子键较难被破坏
是因为其中的离子键较难被破坏
查看答案和解析>>
科目: 来源: 题型:
【题目】利用电解法制取 Na2FeO4 的装置图如图所示,下列说法正确的是(电解过程中温度保 持不变,溶液体积变化忽略不计)
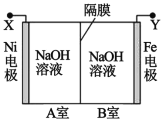
A.Y 是外接电源的正极,Fe 电极上发生还原反应
B.Ni 电极上发生的电极反应为:2H2O - 4e-== O2↑+4H+
C.若隔膜为阴离子交换膜,则电解过程中 OH-由 B 室进入 A 室
D.电解后,撤去隔膜,充分混合,电解液的 pH 比原来小
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.1 mol·L1盐酸滴定10.0 mL浓度为0.1 mol·L1Na2A溶液,所得滴定曲线如图所示。下列说法错误的是
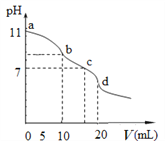
A.Ka2(H2A)的数量级为109
B.当V=5时:c(A2)+c(HA)+c(H2A)=2c(Cl)
C.NaHA溶液中:c(Na+)>c(HA)>c(A2)>c(H2A)
D.c点溶液中:c(Na+)>c(Cl)>c(H+)=c(OH)
查看答案和解析>>
科目: 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以物质a为原料合成扁桃酸衍生物b的过程如下:下列说法正确的是( )
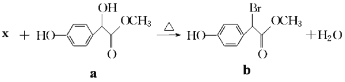
A.物质X是Br2, 物质a转化为b属于取代反应
B.lmol物质a能与3molH2反应,且能在浓硫酸中发生消去反应
C.物质b具有多种能与NaHCO3反应的同分异构体
D.物质b的核磁共振氢谱有四组峰
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中![]() 假设容器体积不变,固体试样体积忽略不计
假设容器体积不变,固体试样体积忽略不计![]() ,使其达到分解平衡:
,使其达到分解平衡:![]() 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
温度 |
|
|
|
|
|
平衡气体总浓度 |
|
|
|
|
|
下列有关叙述正确的是
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应![]() 、
、![]() ,所以在低温下自发进行
,所以在低温下自发进行
C.达到平衡后,若在恒温下压缩容器体积,体系中气体的浓度增大
D.根据表中数据,计算![]() 时的分解平衡常数约为
时的分解平衡常数约为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com