
科目: 来源: 题型:
【题目】已知下列方程式:8Fe+30HNO3→8Fe(NO3)3+3N2O↑+15H2O
(1)标出上述反应电子转移的方向和总数______。
(2)上述反应中______元素被还原,氧化产物为______,若反应中生成标准状态下的N2O气体2.24L则转移的电子数目为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,某微生物燃料电池的工作原理如图所示,下列说法错误的是

A.b电极发生还原反应:4H++O2+4e-=2H2O
B.电路中有4mol电子发生转移,大约消耗标准状况下22.4L空气
C.维持两种细菌存在,该装置才能持续将有机物氧化成CO2并产生电子
D.HS-在硫氧化菌作用下转化为![]() 的反应是
的反应是![]() =
=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】含元素碲(Te)的几种物质存在如图所示转化关系。下列说法错误的是
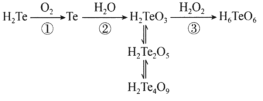
A.反应①利用了H2Te的还原性
B.反应②中H2O作氧化剂
C.反应③利用了H2O2的氧化性
D.H2Te2O5转化为H2Te4O9发生了氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为![]()
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是五种短周期主族元素,其中A是元素周期表中原子半径最小的元素;B是形成化合物种类最多的元素;C是地壳中含量最多的元素;D的气态氢化物的水溶液显碱性;E金属制成金属板后,经加工可制成一种高质量的反光镜,该金属粉末和氧化铁混合常用于焊接钢轨.
(1)写出C、E的元素符号______、______。
(2)B元素位于周期表中的位置为______,BC2的电子式为______(用元素符号表示)。
(3)A、B、C、D的原子半径由大到小的顺序为______(用元素符号表示)。
(4)E的最高价氧化物对应的水化物与短周期元素中最高价氧化物对应水化物碱性最强的物质在溶液中反应的离子方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3ySO3zH2O),为测定某碱式硫酸铁的组成,取5.130g样品溶于足量盐酸中,然后加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g,向上述滤液中加入过量的NaOH溶液,经过滤、洗涤、灼烧得到固体1.600g,该样品的化学式为( )
A.Fe2O32SO37H2OB.4Fe2O310SO325H2O
C.3Fe2O36SO320H2OD.2Fe2O35SO317H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】相对分子质量约为4000的聚乙二醇具有良好的水溶性,是一种缓泻剂。聚乙二醇可由环氧乙烷在酸性条件下聚合而成(![]() )。下列说法正确的是
)。下列说法正确的是
A.环氧乙烷在酸性条件下发生加聚反应制得聚乙二醇
B.聚乙二醇的结构简式为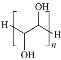
C.相对分子质量约为4000的聚乙二醇的聚合度n≈67
D.聚乙二醇能保持肠道水分的原因是其可和H2O分子间形成氢键
查看答案和解析>>
科目: 来源: 题型:
【题目】硒(Se)元素是人体必需的微量元素之一。下列说法正确的是
A.硒的摄入量越多对人体健康越好B.SeO32-空间构型为正四面体
C.H2Se的熔沸点比H2S高D.H2SeO4的酸性比H2SO4强
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
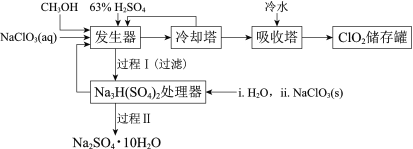
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
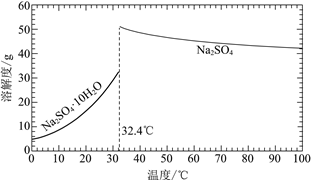
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
查看答案和解析>>
科目: 来源: 题型:
【题目】PCl3主要用于制造敌百虫等有机磷农药和磺胺嘧啶(S.D)等医药的原料。如图为实验室中制取粗PCl3产品的装置,夹持装置略去。
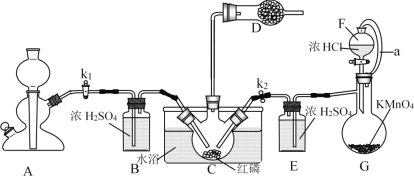
经查阅资料知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3。PCl3遇O2会生成POCl3(三氯氧磷),PCl3、POCl3的熔沸点见下表。
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
回答下列问题:
(1)仪器G的名称是______。装置F与G由橡胶管a相连通,a的作用是_______。
(2)A是制取CO2装置,CO2的作用是_____,选择A中的药品是_____(填字母)。
a.稀盐酸 b.稀硫酸 c.NaHCO3粉末 d.块状石灰石
(3)装置D中盛有碱石灰,其作用是__________________。
(4)装置G中生成Cl2,反应的离子方程式为___________。
(5)装置C采用65-70℃水浴加热,制得的PCl3粗产品中常含有POCl3、PCl5等杂质,除杂的方法是:先加入红磷加热,除去PCl5,然后通过___________(填实验操作名称),即可得到较纯净的PCl3。
(6)通过实验测定粗产品中PCl3的质量分数,实验步骤如下(不考虑杂质的反应):
第一步:迅速移取20.0 g PCl3粗产品,加水完全水解后,再配成500mL溶液;
第二步:移取25.00mL溶液置于锥形瓶中;
第三步:加入0. 5molL-1碘溶液20mL,碘过量,H3PO3完全反应生成H3PO4;
第四步:加入几滴淀粉溶液,用1.0 molL-1Na2S2O3标准溶液滴定过量的碘,反应方程式为I2+2Na2S2O3=Na2S4O6+2NaI,滴至终点时消耗Na2S2O3标准溶液12mL。
①第三步中反应的化学方程式为_____________。
②根据上述数据,计算该产品中PCl3的质量分数为______%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com