
科目: 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。

下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学——有机化学基础)
聚酰胺—66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成:

已知反应:![]()
(1)能与银氨溶液反应的B的同分异构体的结构简式为_________________,
(2)D的结构简式为____________,①的反应类型为_____________,
(3)为检验D中的官能团,所用试剂包括NaOH水溶液及___________,
(4)由F和G生成H的反应方程式为____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)铁在元素周期表中的位置为_____,基态铁原子有个未成对电子_____,三价铁离子的电子排布式为_____。
(2)基态Si原子中,电子占据的最高能层符号_____,该能层具有的原子轨道数为_____;铝元素的原子核外共有_____种不同运动状态的电子、_____种不同能级的电子。
(3)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_____形象化描述。在基态14C原子中,核外存在_____对自旋相反的电子。
(4)中国古代四大发明之一——黑火药,它的爆炸反应为:2KNO3+3C+S![]() K2S+N2↑+3CO2↑,除S外,上述元素的电负性从大到小依次为_____,第一电离能从大到小依次为_____。
K2S+N2↑+3CO2↑,除S外,上述元素的电负性从大到小依次为_____,第一电离能从大到小依次为_____。
(5)有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4,⑥CH4,⑦H2,⑧H2O2,⑨HCN(H—C≡N),⑩Ar,既有σ键又有π键的是______;含有由两个原子的s轨道重叠形成的σ键的是______;不存在化学键的是______。
(6)在BF3分子中,F—B—F的键角是______,硼原子的杂化轨道类型为______,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】锂离子电池己被广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯(DEC)作电解液。
(1)Fe2+基态核外电子排布式为 ________。
(2)PO43-的空间构型为 ________ (用文字描述)。
(3)![]() 中
中![]() 的配位数为6,该配合物中的配位原子为 _____。
的配位数为6,该配合物中的配位原子为 _____。
(4)碳酸二乙酯(DEC)的分子结构如图所示,分子中碳原子的轨道杂化类型为_____,1mol碳酸二乙酯(DEC)中含有σ键的数目为_____。
![]()
(5)氮化锂是一种新型无机贮氢材料,其晶胞结构如图所示,该晶体的化学式为_______。
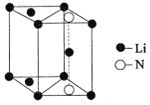
查看答案和解析>>
科目: 来源: 题型:
【题目】H2O2的制取及其在污水处理方面的应用是当前科学研究的热点。
(1)“氧阴极还原法”制取H2O2的原理如题图所示:
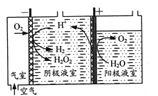
阴极表面发生的电极反应有:
Ⅰ.2H++O2+2e-=H2O2
Ⅱ. H2O2+2H++ 2e-=2H2O
Ⅲ. 2H+ +2e-=H2↑
①写出阳极表面的电极反应式:___。
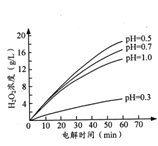
②其他条件相同时,不同初始pH(均小于2)条件下,H2O2浓度随电解时间的变化如图所示,c(H+)过大或过小均不利于H2O2制取,原因是_______。
(2)存碱性条件下,H2O2的一种催化分解机理如下:
H2O2(aq)+Mn2+(aq)=·OH(aq)+Mn3+(aq)+OH-(aq) H=akJ/mol
H2O2(aq)+ Mn3+(aq) +2OH-(aq)= Mn2+(aq) +·O2-(aq) +2H2O(l) H=bkJ/mol
·OH(aq) +·O2-(aq)=O2(g) +OH-(aq) H=ckJ/mol
2H2O2(aq)= 2H2O(l)+O2(g) △H=_______ 。该反应的催化剂为 ____。
(3)H2O2、O3在水中可形成具有超强氧化能力的羟基自由基(·OH),可有效去除废水中的次磷酸根离子(H2PO2-)。
①弱碱性条件下·OH将H2PO2-氧化成PO43-,理论上l.7g·OH可处理含0.001mol/L H2PO2-的模拟废水的体积为______。
②为比较不同投料方式下含H2PO2-模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4。反应相同时间,实验结果如图所示:
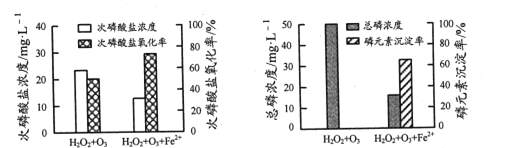
添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】对应下列叙述的微粒M和N,肯定属于同主族元素且化学性质相似的是( )
A.原子核外电子排布式:M为1s22s2,N为1s2
B.结构示意图:M![]() ,N
,N![]()
C.M原子基态2p轨道上有一对成对电子,N原子基态3p轨道上有一对成对电子
D.M原子基态2p轨道上有1个未成对电子,N原子基态3p轨道上有1个未成对电子
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体形分子且键角都为109°28′
C. NH4+的电子式为 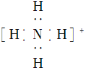 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:
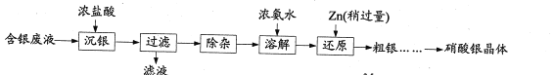
已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
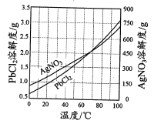
③PbCl2、AgNO3的溶解度曲线如图所示:
(1)“滤液”中的主要阳离子为___(填化学式)。
(2)“除杂”分为两步:先除去PbCl2,再除去Ag2S。
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为______,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是_______。
(3)室温下,可逆反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数K=___。{Ksp(AgCl)= 1.8×10-10,Ag++2NH3·H2O[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)“还原”过程中发生反应的离子方程式为_____ 。
(5)粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:________,过滤,________,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液_______,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaC12溶液)
查看答案和解析>>
科目: 来源: 题型:
【题目】NaBH4是一种常见的还原剂。一种以H2、Na、硼酸三甲酯[B(OCH3)3]为原料,生产NaBH4的工艺流程如下:
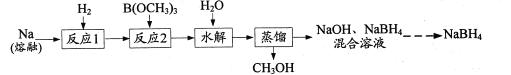
(1)下列措施能提高“反应1”的化学反应速率的有______(填字母)。
A.充分搅拌熔融钠
B.将熔融钠充分分散在石蜡油中
C.反应前排尽装置中的空气
(2)在浓硫酸作用下,B(OCH3)3可由B(OH)3和CH3OH发生酯化反应制得。浓H2SO4的作用是_____。
(3)“反应2”在240℃条件下进行,生成的产物是NaBH4和CH3ONa,写出该反应的化学方程式:____ 。“反应2”所用B(OCH3)3需充分干燥,原因是______。
(4)反应NaBH4+2H2O=NaBO2+4H2 可用于制取H2。一定浓度的NaBH4催化制氢的半衰期(溶液中NaBH4消耗一半时所需的时间)与溶液pH的关系如图所示:
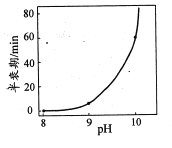
①NaBH4与水反应所得溶液呈碱性,原因是____。
②随着反应的进行,生成H2的速率逐渐减慢,原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或有关化学用语的使用正确的是( )
A.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
B.Fe原子的外围电子排布图为![]()
C.氧的电负性比氮大,故氧元素的第一电离能比氮元素的第一电离能大
D.铜原子的外围电子排布式为3d94s2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com