
科目: 来源: 题型:
【题目】第VA族元素在生产、生活中有重要用途。回答下列问题:
(1)三聚磷酸钠(俗称“五钠”常用于食品生产中,作水分保持剂、品质改良剂等。
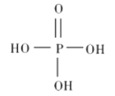
①磷酸的结构式如图所示,其主要的电离方程式为______________。
②三聚磷酸是三分子磷酸脱去两分子水后的产物,三聚磷酸钠的化学式为_______________。
(2)在碱性条件下,次磷酸盐(H2PO2-)可用于化学镀银,写出其反应的离子方程式______________。(氧化产物与还原产物物质的量之比为1:4)
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:
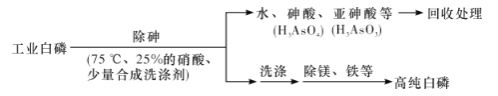
①除砷过程在75 ℃下进行,其合理的原因是____________(填字母代号)。
a,使白磷熔化,并溶于水 b.降低白磷的毒性
c.温度不宜过高,防止硝酸分解 d.适当提高温度,增大反应速率
②硝酸氧化除砷时被还原为NO,写出砷转化为亚砷酸的化学方程式:______________________________。
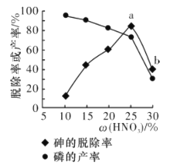
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如图所示,砷的脱除率从a点到b点降低的原因是__________________。
(4)常温下银氨溶液中存在平衡:Ag+(aq) + 2NH3(aq) ![]() Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq)
Ag(NH3)2+(aq),K=l.10×107 ;已知常温下Ksp(AgCl)=1.45×10-10计算可逆反应AgCl(s) +2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________(保留2位有效数字)。1L1mol/L氨水中最多可以溶解AgCl ______mol(保留1位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________(保留2位有效数字)。1L1mol/L氨水中最多可以溶解AgCl ______mol(保留1位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发)。下列叙述不正确的是
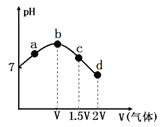
A.由a点到b点的过程中,溶液中 增大
增大
B.由图可知(NH4)2CO3溶液显碱性、NH4Cl溶液显酸性
C.c点所示溶液中,c(NH4+)>c(CO32-)>c(OH-)>c(H+)
D.d点所示溶液中,c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室利用下列装置可测量一定质量的钢材中的含碳量(部分夹持装置已略去)。下列有关判断正确的是
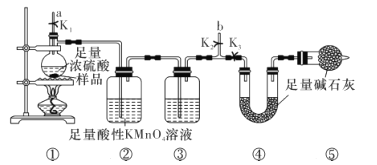
A.实验时,先打开K1、K2,关闭K3,从a处通入N2目的是排出装置中的CO2
B.点燃酒精灯前,需要打开K1、关闭K2,打开K3 ,K1起到平衡气压的作用
C.装置②中的酸性KMnO4溶液吸收H2S,装置③盛有浓硫酸,起到干燥作用
D.实验前后需称取装置④和装置⑤的质量,才能准确地测得钢材的含碳量
查看答案和解析>>
科目: 来源: 题型:
【题目】以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如图。下列说法正确的是
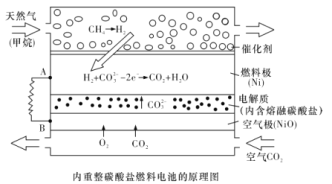
A.以此电池为电源电解饱和食盐水,当有0.2 mol e-转移时,阳极产生2.24 L气体
B.若以甲烷为燃料气时负极电极反应式:CH4+5O2- - 8e - =CO32- +2H2O
C.该电池使用过程中需补充Li2CO3和K2CO3
D.空气极发生的电极反应式为O2+4e- +2CO2 =2CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.1.6g-NH2和1.5g-CH3含有的电子数均为NA
B.44 g CO2和N2O的混合物中含有的氧原子数为1. 5NA
C.精炼铜,若阳极失去2NA个电子,则阴极增重64 g
D.60 g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C—O键数目为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验事实能说明HNO2是弱电解质的是
①HNO2溶液与NaHCO3溶液混合,放出气泡
②用HNO2溶液做导电性实验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应
④0.1mol·L -1HNO2溶液中,c(H+)=0.015mol·L-1
⑤相同浓度时,HNO2溶液的导电能力比盐酸弱
⑥取0.1mol·L -1HNO2溶液200mL,加水至体积为2L,pH>2
A.①②③B.④⑤⑥C.①③④D.①④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】关于水解应用的说法,错误的是
A.草木灰(主要含K2CO3)与铵态氮肥最好不混用
B.明矾用于净水
C.向CuCl2溶液中加入Cu(OH)2,调节pH可除去溶液中混有的少量Fe3+
D.将AlCl3、Al2(SO4)3溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体成分相同
查看答案和解析>>
科目: 来源: 题型:
【题目】辣椒的味道主要来自辣椒素类化合物。一种合成辣椒素中间体![]()
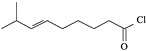
![]() 的合成路线如下:
的合成路线如下:
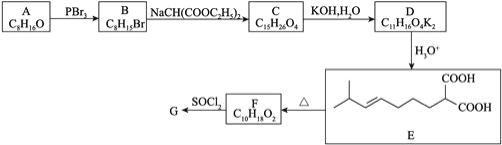
回答下列问题:
![]() 中所含官能团的名称为_____________。
中所含官能团的名称为_____________。
![]() 的结构简式为______________________。
的结构简式为______________________。
![]() 、
、![]() 的反应类型分别是______________、______________。
的反应类型分别是______________、______________。
![]() 的化学方程式为___________________________。
的化学方程式为___________________________。
![]() 满足下列条件的E的同分异构体有________种
满足下列条件的E的同分异构体有________种![]() 不考虑立体异构
不考虑立体异构![]() 。
。
![]() 含有一个六元碳环
含有一个六元碳环![]() 环上三个碳原子分别连有一个取代基且其中两个为羧基。其中核磁共振氢谱有7组峰的结构简式为______________。
环上三个碳原子分别连有一个取代基且其中两个为羧基。其中核磁共振氢谱有7组峰的结构简式为______________。
![]() 参照上述合成路线,以1,
参照上述合成路线,以1,![]() 丁二烯和
丁二烯和![]() 为原料
为原料![]() 无机试剂任选
无机试剂任选![]() ,设计制备
,设计制备 的合成路线_______________。
的合成路线_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】扁桃酸是唯一具有脂溶性的果酸,在医药工业可用于头孢羟唑、血管扩张药环扁桃酸酯、滴眼药羟苄唑、匹莫林等的中间体,也可作防腐剂。实验室用如下原理制备:

合成扁桃酸的实验步骤、装置示意图及相关数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ | 溶解性 |
扁桃酸 | 无色透明晶体 | 119 | 300 | 易溶于热水、乙醚和异丙醇 |
乙醚 | 无色透明液体 | -116.3 | 34.6 | 溶于低碳醇、苯、氯仿,微溶于水 |
苯甲醛 | 无色液体 | -26 | 179 | 微溶于水,能与乙醇、乙醚、苯、氯仿等混溶 |
氯仿 | 无色液体 | -63.5 | 61.3 | 易溶于醇、醚、苯、不溶于水 |
实验步骤:

步骤一:向如图所示的实验装置中加入0.1mol(约l0.1mL)苯甲醛、0.2mol(约16mL)氯仿,慢慢滴入含19g氢氧化钠的溶液,维持温度在55~60℃,搅拌并继续反应1h,当反应液的pH接近中性时可停止反应。
步骤二:将反应液用200mL水稀释,每次用20mL乙醚萃取两次,合并醚层,待回收。
步骤三:水相用50%的硫酸酸化至pH为2~3后,再每次用40mL乙醚分两次萃取,合并萃取液并加入适量无水硫酸钠,蒸出乙醚,得粗产品约11.5g。请回答下列问题:
(1)图中仪器C的名称是_________________,装置B的作用是_____________
(2)步骤一中合适的加热方式是_____________________。
(3)步骤二中用乙醚的目的是_____________________。
(4)步骤三中加入适量无水硫酸钠的目的是_____________________。
(5)该实验的产率为____________(保留三位有效数字)。
(6)扁桃酸在高端化学中也有很重要的作用,如以扁桃酸与正丁醇为原料,在催化剂的催化下可合成手性拆分剂扁桃酸正丁酯,试写出该反应的化学方程式___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以菱镁矿(主要成分为MgCO3含少量FeCO3)为原料制备金属镁的实验流程如下:
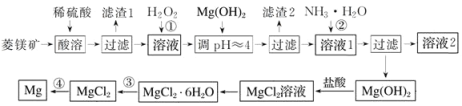
已知:一些金属离转化为氢氧化物沉淀时溶液的pH如表所示
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
完全沉淀时 | 3.7 | 5.2 | 9.7 |
请回答:
(1)上述流程中H2O2的作用是:_____________
(2)滤渣2的主要成分为:_______________;溶液2中的主要溶质为:__________________。
(3)通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,为保证Mg2+沉淀完全,过程②中控制溶液的pH至少为__________________(保留小数点后一位)(已知Mg(OH)2的Ksp=2×10-11,lg2=0.3)
(4)已知MgCl2·6H2O受热时发生水解:MgCl2·6H2O=Mg(OH)Cl+HCl↑+H2O,过程③应该如何操作才能得到无水MgCl2__________________
(5)写出过程④中发生反应的化学方程式:____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com