
科目: 来源: 题型:
【题目】某温度下,在一恒容容器中进行如下反应 A(g)+3B(g) ![]() 2C(g),下列情况一定能说明反应已达到平衡的是
2C(g),下列情况一定能说明反应已达到平衡的是
①单位时间内,有1molB反应,同时有2molC生成
②容器内压强不随时间而变化
③单位时间内,有2molC生成,同时有1molA生成
④用 A、B、C表示的该反应的化学反应速率之比为 1∶3∶2
⑤气体的平均摩尔质量不随时间而变化⑥气体的密度不随时间而变化
A.①④⑥B.①②③C.①②⑥D.②③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.14g聚丙烯中含C-H键总数目为2NA
B.常温下,pH=13的NaOH溶液中含有的OH-数目为0.1NA
C.100mL12mol·L-1浓硝酸与过量Cu反应转移电子的数目为0.6NA
D.电解精炼铜时,若阳极质量减少64g,则阴极得到电子的数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】由O2、NO2 和熔融NaNO3组成的燃料电池如图所示,在该电 池工作过程中石墨I电极产生一种气态氧化物Y。下列说法正确的是
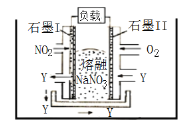
A.电子由负载流向石墨I
B.Y可能为NO
C.石墨I上发生还原反应
D.石墨II上的电极反应: O2 + 2N2O5 + 4e- = 4NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
Ⅰ.铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如图:

(1)写出反应1中涉及的任意一个化学方程式____;
(2)滤液Ⅰ中加入CaO生成的沉淀是____,已知气体A在标准状况下的密度为1.96g/L,写出A过量时,反应2的离子方程式____;
Ⅱ.以萤石(CaF2)和纯碱为原料制备冰晶石的流程如图:

(3)萤石(CaF2)的电子式____;
(4)若E为硫酸钙,D为最稳定的气态氢化物,则化合物C是____,写出由D制备冰晶石(Na3AlF6)的化学方程式____。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气与适量氯气混合反应可生成NH4Cl(岩脑砂的主要成分)和一种无污染的气体。某学习小组利用下列装置模拟该反应,请回答相关问题。
A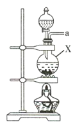 B
B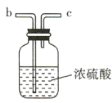
C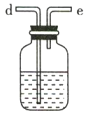 D
D
(1)该实验中所需的氯气是用浓盐酸与MnO2反应制取。装置A中仪器X的名称为 ________________ 。
(2)要得到干燥纯净的氯气,A、B、C装置中导管的连接顺序为a→ ________________ → ________________ → ________________ → ________________ 。
(3)利用D装置,将适量氨气与氯气充分混合,氨气应从__________ 通入,反应的化学方程式为 ___________;可能观察到的现象是________________。
(4)现取岩脑砂进行NH4Cl含量的测定。准确称取一定质量的岩脑砂,与足量的氧化铜混合,如图所示进行实验。已知:2NH4Cl+3CuO![]() 3Cu+N2↑+2HCl↑+3H2O
3Cu+N2↑+2HCl↑+3H2O
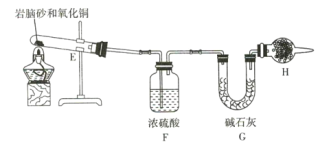
①为顺利完成有关物理量的测定,请完善下列表格。
测量时间点 | 反应前 | 反应后 |
测量内容 | ________________ | 当观察到 ________________ 现象时停止加热,冷却,称量H装置的总质量 |
②如果不用H装置,测出NH4Cl的含量将 _____ (填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向1.0L的密闭容器中加入0.60molX(g),发生反应X(g)![]() Y(s)+2Z(g),测得反应物X的浓度与反应时间的关系如表所示:
Y(s)+2Z(g),测得反应物X的浓度与反应时间的关系如表所示:
反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
c(X)/(mol·L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
(1)0~3min内用Z表示的平均反应速度v(Z)=___。
(2)分析该反应中反应物的浓度与时间的关系,得出的结论是___。由此规律推出在6min时反应物X的浓度为___mol·L-1。
(3)该反应的逆反应速率随时间变化的曲线如图所示,t2时改变的条件可能是___、___。

查看答案和解析>>
科目: 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A.溴化亚铁溶液中通少量的氯气:2Br-+ Cl2=== 2Cl-+ Br2
B.氢氧化铁悬浊液溶于氢碘酸溶液中:2Fe(OH)3+6H++2I- = 2Fe2++I2+6H2O
C.碳酸氢钙与少量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D.稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在 1标准大气压、25℃ 下,1mol 气态 AB 分子生成气态 A 原子和 B 原子的过程中所吸收的能量称为AB间共价键的键能,已知水分子的能量变化关系图如下:

下列说法正确的是
A.△H1<0,且△H3 <△H4
B.△H4 是 O2的键能
C.△H5 =△H1+△H2+△H3+△H4
D.△H3+△H4 >△H5
查看答案和解析>>
科目: 来源: 题型:
【题目】将11.2 g铁粉投入到盛有100 mL 、3 mol·L-1稀硫酸的烧杯中,4 min时铁粉刚好溶解(溶解前后溶液体积变化忽略不计),下列表示这个反应的速率正确的是
A.v(Fe)=0.5 mol/(L·min)B.v(H2SO4)=1.5 mol/(L·min)
C.v(H2SO4)=0.5 mol/(L·min)D.v(FeSO4)=1 mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com