
科目: 来源: 题型:
【题目】在电解冶炼铝的过程中加入冰晶石(Na3AlF6)可起到降低Al2O3熔点的作用。
(1)基态氟原子中,电子占据的最高能层的符号为______,电子占据最高能级上的电子数为______。
(2)向NaAlO2及氟化钠溶液中通入CO2,可制得冰晶石。
①该反应中涉及的非金属元素的电负性由大到小的顺序为______________。
②1molCO2中含有的σ键数目为________,其中C原子的杂化方式为_________;CO2与SCNˉ互为等电子体,SCNˉ的电子式为_________。
③Na2O的熔点比NaF的高,其理由是:_________。
(3)冰晶石由两种微粒构成,冰晶石的晶胞结构如图所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处△所代表的微粒是________(填微粒符号)。
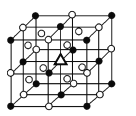
(4)冰晶石稀溶液中存在的化学键有________(填标号)。
A 离子键 B 共价键 C 配位键 D 氢键
(5)金属铝晶体中的原子堆积方式为面心立方最密堆积,其晶胞参数为apm,则铝原子的半径为______pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】改革开放四十年来,我国在很多领域取得了举世瞩目的成就,下列工程使用的部分材料如下所示,其中属于有机高分子的是
A.  港珠澳大桥桥墩——混凝土
港珠澳大桥桥墩——混凝土
B.  “人造太阳”核聚变实验装置——钨合金
“人造太阳”核聚变实验装置——钨合金
C.  高铁轨道与地基之间填隙减震——聚氨酯
高铁轨道与地基之间填隙减震——聚氨酯
D.  “玉兔”月球车太阳能电池帆板——硅
“玉兔”月球车太阳能电池帆板——硅
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S是石油化工行业广泛存在的污染性气体,但同时也是重要的氢源和硫源,工业上可以采取多种方式处理。
Ⅰ.干法脱硫
(1)已知H2S的燃烧热为akJmol-1 ,S的燃烧热为bkJmol-1 ,则常温下空气直接氧化脱除H2S的反应:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=______kJmol-1 。
(2)常用脱硫剂的脱硫效果及反应条件如下表,最佳脱硫剂为_________。
脱硫剂 | 出口硫(mg·m-3) | 脱硫温度(℃) | 操作压力(MPa) | 再生条件 |
一氧化碳 | <1.33 | 300~400 | 0~3.0 | 蒸气再生 |
活性炭 | <1.33 | 常温 | 0~3.0 | 蒸气再生 |
氧化锌 | <1.33 | 350~400 | 0~5.0 | 不再生 |
锰矿 | <3.99 | 400 | 0~2.0 | 不再生 |
Ⅱ.热分解法脱硫
在密闭容器中,充入一定量的H2S气体,发生热分解反应H2S(g)![]() 控制不同的温度和压强进行实验,结果如图(a)。
控制不同的温度和压强进行实验,结果如图(a)。
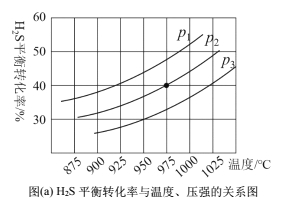
(3)图(a)中压强关系p1、p2、p3由大到小的顺序为______,该反应为____(填“吸热”或“放热”)反应,若要进一步提高H2S的平衡转化率,除了改变温度和压强外,还可以采取的措施有_______。
(4)压强为p、温度为975℃时,![]() 的平衡常数K=0.04,则起始浓度c=______molLˉ1,若向容器中再加入1molH2S气体,相同温度下再次达到平衡时,K_____0.04(填“>”1 “<”或“=”)。
的平衡常数K=0.04,则起始浓度c=______molLˉ1,若向容器中再加入1molH2S气体,相同温度下再次达到平衡时,K_____0.04(填“>”1 “<”或“=”)。
Ⅲ.间接电解法脱硫
间接电解法是通过FeCl3溶液吸收并氧化H2S气体,将反应后溶液通过电解再生,实现循环使用,该法处理过程如下图(b)。
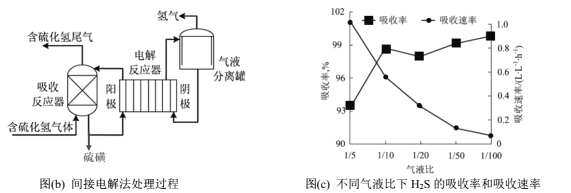
(5)电解反应器总反应的离子方程式为________。
(6)气液比为气体与液体的流速比,吸收反应器内液体流速固定。测定吸收器中相同时间内不同气液比下H2S的吸收率和吸收速率,结果如图(c)所示,随着气液比减小,H2S的吸收速率逐渐降低,而吸收率呈上升趋势的原因为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,三种盐的沉淀溶解平衡曲线如图所示,已知pM为阳离子浓度的负对数,pR为阴离子浓度的负对数,下列说法正确的是

A.Y点:![]() ,Z点:
,Z点:![]()
B.溶度积:Ksp(MnCO3)>Ksp(CaCO3)>Ksp(CaSO4)
C.X点对应的CaCO3溶液为不饱和溶液,可以继续溶解CaCO3
D.T℃时,![]() 的平衡常数K的数量级为103
的平衡常数K的数量级为103
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T(℃) | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______。
(2)该反应为______反应(选填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_____。
a.容器中压强不变 b.υ正(H2)=υ逆(H2O)
c. c(CO2)=c(CO) d.混合气体中 c(CO)不变
(4) 830K时,各物质浓度符合下式:2c(CO2)·c(H2)=c(CO)·c(H2O),此时该反应 _______(填“正反应方向进行”、“逆反应方向进行”或“处于平衡状态”)。
Ⅱ.将1 mol I2(g) 和2 mol H2置于2 L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
(1)若5分钟该达平衡,则用H2表示的反应速率为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,则甲条件可能是____。(填入下列条件的序号)
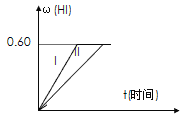
①恒温条件下,缩小反应容器体积;②恒温条件下,扩大反应容器体积;③恒容条件下,降低温度;④恒容条件下,升高温度;⑤恒温恒容条件下,加入适当催化剂。
查看答案和解析>>
科目: 来源: 题型:
【题目】在进行锌铜双液原电池实验时,若用铜丝代替盐桥(如图),外电路中仍然存在较小的电流,随着时间 的推移,电流逐渐减小。下列关于该装置说法错误的是
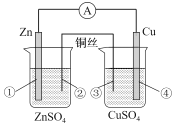
A.左池形成了原电池,Zn极的电势最高
B.铜丝②附近溶液的pH将升高
C.右池为电解池,铜丝③的反应式为 Cu-2eˉ=Cu2+
D.铜片④上有新的亮红色固体附着
查看答案和解析>>
科目: 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为______。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,E(H﹣Cl)=432kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣H)=_____。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
(4)如图是N2(g)和H2(g)反应生成2molNH3(g)过程中能量变化示意图:
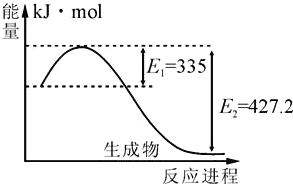
①请计算每生成1molNH3放出热量为:______。
②若起始时向容器内充入1molN2和3molH2达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种广泛用于锂离子电池的物质结构如图所示。X、Y、Z、W为原子序数依次递增的四种短周期主族元素,Y、W同主族,原子半径r(X)>r(Y)>r(Z)。下列说法正确的是
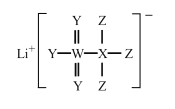
A.X的氢化物中只有极性键
B.Y在该物质中有两种不同价态
C.Z的单质能与水反应生成Y的单质
D.简单离子的还原性W<Y
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.2000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1) 配平离子方程式:______MnO4-+HSO3-+H+=Mn2++SO42-+H2O。
(2)用KMnO4进行滴定时,KMnO4溶液应装在_______________中,判断滴定终点的现象是_______。
(3)下列操作会导致测定结果偏高的是_________。
A. 盛装未知浓液的锥形瓶用蒸馏水洗过,未用待测液润洗
B. 未用标准浓度的酸性KMnO4溶液润洗滴定管
C. 观察读数时,滴定前仰视,滴定后俯视
D. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4) 根据下表测定的实验数据,计算KMnO4溶液体积的平均值为___mL;NaHSO3溶液的物质的量浓度为___mol/L(数据精确到0.1)。
试验编号 | 待测NaHSO3溶液的体积/ mL | KMnO4溶液体积/ mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.电解饱和食盐水,阳极生成22.4L气体时,转移的电子数为2NA
B.高温下,16.8gFe与足量水蒸气完全反应失去的电子数目为0.8NA
C.一定条件下,丁烷催化裂解生成1mol乙烯时,消耗丁烷分子的数目为NA
D.10g46%甲酸(HCOOH)水溶液中所含的氧原子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com