
题目列表(包括答案和解析)
10.A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。下列说法中正确的是( )
A.A、C两元素处在元素周期表中的第ⅣA族
B.B、D两元素组成的离子化合物中阴、阳离子的个数比为1∶1
C.B、C、D三种元素组成的化合物的化学式为DCB2
D.B、C、D三种元素的简单离子的半径大小顺序为:C>D>B
解析:因A、C同主族,且为短周期元素,所以其原子序数相差2或8,若相差2,显然不合题意;又因C原子核内的质子数等于A、B原子核内的质子数之和,可以推测B为8号元素,为氧元素;C原子最外层电子数是D原子最外层电子数的3倍,若D的最外层电子数为1,则C为铝,A为硼,D为钠;若D的最外层电子数为2,则C为硫,A为氧,显然不合题意;据此可知,选项A、D不正确,C正确;由于Na2O中阴、阳离子的个数比为1∶2,所以选项B不正确;选C。
答案:C
9. 有X、Y、Z、W四种含氧酸,其成酸元素均为元素周期表中的短周期元素。将分别含有一定质量的X、Y、Z、W的水溶液进行光照或微热(有关的反应均进行完全),测得的数据如下表:
|
含氧酸 |
X |
Y |
Z |
W |
|
含氧酸的质量/g |
25.2 |
a |
3.1 |
10.5 |
|
生成物U的质量/g |
3.2 |
/ |
/ |
3.2 |
|
生成物V的质量/g |
3.6 |
0.9 |
0.9 |
/ |
|
不同生成物Q的质量/g |
18.4 |
3.2 |
b |
c |
据此判断下列叙述正确的是( )
A.表中的数据a=5.1 g
B.含氧酸Y为硫酸
C.四种含氧酸的成酸元素的化合价分别为+4、+5
D.四种含氧酸中有一种是强电解质、三种是弱电解质
解析:在常见含氧酸中,光照或加热分解产物有三种的有硝酸,据此可以确定X为HNO3,则U为O2,V为H2O,Q为NO2;由质量守恒可知a=0.9+3.2=4.1,b=3.1-0.9=2.2 g,c=10.5-3.2=7.3,并由此可以确定Y为H2SO3,Z为H2CO3,W为HClO,所以选项D正确,A、B、C不正确;选D。
答案:D
8.下列微粒半径大小的比较正确的是( )
A.Na+<Mg2+<Al3+<O2- B.S2-<Cl-<Na+<Al3+
C.Na<Mg<Al<S D.Cs>Rb>K>Na
思路分析:在现阶段对除稀有气体元素原子以外的任何原子或离子的半径进行比较要“三看”:①首先看层,层少半径小;②同层看核,核大半径小;③同核看价,价高半径小。
解析:A项中Na+、Mg2+、Al3+、O2-都具有相同的电子层结构,核电荷数越大,微粒半径越小,即微粒半径由大到小的顺序是O2->Na+>Mg2+>Al3+,A选项不正确。B项中,S2-和Cl-具有相同的电子层结构,由上述规律知:r(S2-)>r(Cl-),同理r(Na+)>r(Al3+),但Cl-比Na+多一个电子层,显然r(Cl-)>r(Na+),故离子半径大小是S2-<Cl-<Na+<Al3+,B选项不正确。C选项中,Na、Mg、Al、S的电子层数相同,核电荷数越大,半径越小,即:Na>Mg>Al>S,故C选项错误。D中,Cs、Rb、K、Na的最外层电子数相同,电子层数逐渐减少,其原子半径Cs>Rb>K>Na,故D选项正确。
答案:D
7.如图是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元素符号。已知X位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒。下列推测不正确的是( )

A.原子半径X<Y
B.最高价氧化物对应的水化物酸性X>Y
C.X的氢化物具有强还原性
D.Y与碘同周期,Y最高价氧化物对应的水化物酸性比高碘酸(HIO4)强
解析:X的氢化物化学式为XH3,说明X处于ⅤA族,XH3有剧毒,是AsH3,有强还原性,C正确。Y比X多1个电子层,则原子半径Y>X。X非金属性强于Y,B正确。Y与碘同周期,则Y非金属性比I弱,则最高价氧化物对应的水化物比HIO4弱。
答案:D
6.一定条件下,氨气与氟气发生反应:4NH3+3F2===NF3+3NH4F,其中NF3分子构型与NH3相似。下列有关说法错误的是( )
A.NF3是三角锥型分子
B.NF3既是氧化产物,又是还原产物
C.NH4F中既含有离子键又含有共价键
D.上述反应中,反应物和生成物均属于共价化合物
解析:反应中N:-3―→+3,F:0―→-1,NF3类似NH3是极性分子,NF3既是氧化产物又是还原产物,D选项中NH4F是离子化合物。
答案:D
5. 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
A.一个D2O分子所含的中子数为8 B.NH3的结构式为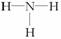
C.HCl的电子式为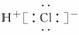 D.热稳定性:H2S>HF
D.热稳定性:H2S>HF
解析:本题主要考查氢化物的表示方法及性质。一个重氢原子D含有一个中子,一个氧原子含有8个中子,故1个D2O分子中所含中子数为10个,A项不正确;HCl为共价化合物,其电子式为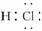 ,C项错误;由于硫的非金属性比氟弱,其氢化物H2S的稳定性比HF弱。
,C项错误;由于硫的非金属性比氟弱,其氢化物H2S的稳定性比HF弱。
答案:B
4.下列分子中的化学键既有极性键又有非极性键的是( )
A.CH3COONH4 B.Cl2
C.NH3 D.N2H4(分子中各原子均达到稳定结构)
解析:只要是分子,分子中的化学键只有共价键,A项错误;单质分子Cl2中只存在Cl-Cl键;D项中N2H4的结构式为: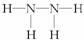 ,存在“N-N”非极性键和“N-H”极性键。
,存在“N-N”非极性键和“N-H”极性键。
答案:D
3. 某元素的原子最外层只有一个电子,它与卤素结合时,所形成的化学键是( )
A.一定是离子键 B.一定是共价键
C.可能是离子键,也可能是共价键 D.以上说法都不正确
解析:原子最外层只有一个电子的元素可能是氢元素,也可能是碱金属元素,因此该元素与卤素结合时,可能形成离子键(如NaCl),也可能形成共价键(如HCl )。
答案:C
2. 已知氢化锂(LiH)属于离子化合物。LiH跟水反应可以放出氢气。下列叙述中正确的是( )
A.LiH的水溶液显中性 B.LiH中的氢离子可以被还原生成氢气
C.LiH是一种强氧化剂 D.LiH中氢离子比锂离子的半径大
解析:在离子化合物LiH中,Li+与H-以离子键结合而成,该物质溶于水生成H2,可以想到H-与水中的H+之间发生氧化还原反应,除生成H2外,另一产物应是LiOH,所以对该反应的分析可根据下列几点:①属于氧化还原反应;②LiH是还原剂,H2O是氧化剂;③所得溶液是LiOH碱性溶液。故A、B、C选项均错。
答案:D
1.下列表示物质结构的化学用语或模型正确的是( )
A.8个中子的碳原子的核素符号:12C
B.HF的电子式: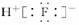
C.Cl-离子的结构示意图: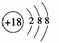
D.CH4分子的比例模型:
解析:本题涉及的都是最基本的化学用语,其中8个中子的碳原子的核素符号应是14C;HF是共价化合物,分子中不存在离子;Cl-离子的结构示意图为 ;CH4分子的比例模型是
;CH4分子的比例模型是 。
。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com