
14.已知25℃时醋酸溶液中存在如下关系c(H+)·c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数。试回答下述问题:
(1)当向该溶液中加入一定量的HCl时,上式中数值是否发生变化?为什么?
(2)若醋酸的起始浓度为0.010mol/L,平衡时的c(H+)是多少?
(提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.010mol/L)
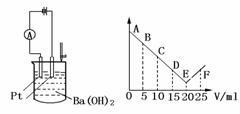
13.如上右图所示:将30ml 0.1mol·L-1Ba(OH)2溶液置于烧杯中,然后慢慢加入0.1mol·L-1某第三周期元素形成的某酸溶液共25mL,加入酸溶液的体积V与电流强度I的I-V图如上右图所示。
(1)此酸的化学式为 ;
(2)处于C点时溶液中导电的阳离子主要是 ;
(3)处于F点时,溶液中导电的阴离子主要是 ;
(4)烧杯中刚加入酸时,观察到的现象是 ;
(5)从A→E电流强度I变小的主要原因是
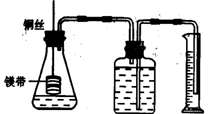
12.某研究性学习小组为证明在同温、同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下左图。该实验的主要操作步骤如下:
①配制浓度均为1mol·L-1盐酸和醋酸溶液。
②用 量取10.00mL 1mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中。
③分别称取除去表面氧化膜的镁带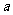 g,并系于铜丝末端,
g,并系于铜丝末端,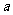 的数值至少为 。
的数值至少为 。
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性。
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 。
⑥反应结束后待温度恢复到室温,若量筒中液面高于广口瓶中液面,读取量筒中水的体积前应 ,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)本实验中应选用 (填序号)的量筒。
A.100mL B.200mL C.500mL
(2)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为Vm= 。
(3)铜丝不与酸接触的原因是 。
11.选用下列试剂:甲基橙溶液、酚酞溶液、稀醋酸、醋酸钠晶体、烧碱、蒸馏水等。设计两两种方法证明醋酸是一种弱电解质(要求回答实验步骤,所用试剂及产生的现象)。
第一种方法: 。
第二种方法: 。
10.有下列物质:⑴金属钠 ⑵石墨 ⑶食盐晶体 ⑷蔗糖 ⑸氯化氢 ⑹二氧化碳
⑺稀硫酸 ⑻盐酸 ⑼硫 ⑽硫酸钡 ⑾乙酸 ⑿熔融氯化钠 ⒀氨气 ⒁氯化银
⑴能导电的有(填序号,下同) ;
⑵属于非电解质的是 ;⑶属于电解质的是 ;
⑷属于强电解质的是 ;⑸属于弱电解质的是 。
9.一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是___________________,
②同体积同物质的量浓度的三种酸,中和NaOH能力的顺序是___________________,
③当其c(H+)相同时,物质的量浓度由大到小的顺序为_____________________,
④当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的
顺序为______________________。
⑤当pH相同、体积相同时,同时加入锌,若产生相同体积的氢气(相同状况)则开
始时反应速率__________________,反应所需的时间___________________。
⑥将c(H+)相同的三种酸均稀释10倍,c(H+)由大到小的顺序为__________________。
8. (2007年高考理综重庆卷)用食用白醋(醋酸浓度约为1 mol/L)进行下列实验,能证明醋酸为弱电解质的是 ( )
A.白醋中滴入石蕊试液呈红色 B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出 D.pH试纸显示醋酸的pH为2-3
7.下列说法正确的是 ( )
A.氯化钠溶液在电流作用下电离成钠离子和氯离子
B.强电解质溶液不一定比弱电解质的导电性强
C.共价键的极性强的化合物一定是强电解质
D.强、弱电解质的导电性只由它们的浓度决定
6.用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是 ( )
A.c(OH-)/c(NH3·H2O) B.c(NH3·H2O)/ c(OH-)
C.c(OH-) D.n(NH4+)
5.下列电离方程式书写正确的是 ( )
A.H2S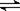 H++HS- HS-=H++S2- B.NaHCO3=Na++HCO3- HCO3-=H++CO32-
H++HS- HS-=H++S2- B.NaHCO3=Na++HCO3- HCO3-=H++CO32-
C.Na2HPO4=2Na++H++PO43- D.HF H++F-
H++F-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com