
21. (10分)现代循环经济要求综合考虑环境污染和经济效益。请填写下列空白。
(10分)现代循环经济要求综合考虑环境污染和经济效益。请填写下列空白。
(1)实验室里,可用于吸收SO2尾气的一种试剂是 。
(2)高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、 FeO、SiO2)为原料制备高纯氧化铁(软磁α- Fe2O3)的生产流程示意图:

 ①步骤I中过滤所得滤渣的主要成分是
。
①步骤I中过滤所得滤渣的主要成分是
。
②步骤II中加入铁粉的目的是 。
③步骤Ⅲ中可选用 试剂调节溶液的pH(填标号)。
A.稀硝酸 B.双氧水 C.氨水 D.高锰酸钾溶液
④写出在空气中煅烧FeCO3,制备高纯氧化铁的化学方程式
。
⑤从滤液C中回收的主要物质的一种用途是 。
20.
 (8分)X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物。它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的)(以下每空中填入一种即可)。
(8分)X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物。它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的)(以下每空中填入一种即可)。




 (1)当X、Y均为金属时,Y的化学式为
,B的化学式为
(1)当X、Y均为金属时,Y的化学式为
,B的化学式为
 (2)当X为非金属且为气体,Y为金属且为紫红色时,X的化学式为 ,A的化学式为
(2)当X为非金属且为气体,Y为金属且为紫红色时,X的化学式为 ,A的化学式为
 (3)当X为金属、Y为非金属且为固体时,X与A反应的化学方程式为
(3)当X为金属、Y为非金属且为固体时,X与A反应的化学方程式为
 (4)当X、Y均为非金属固体时,X与A反应的化学方程式为
(4)当X、Y均为非金属固体时,X与A反应的化学方程式为
19.
 (10分)某兴趣小组同学共同设计了如图所示的实验装置,既可用于制取气体,也可用于验证物质的性质。请回答下列问题:
(10分)某兴趣小组同学共同设计了如图所示的实验装置,既可用于制取气体,也可用于验证物质的性质。请回答下列问题:
(1)利用装置Ⅰ、Ⅱ制取气体(K2关闭,K1打开)。
甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO,你认为是否正确 (填“是”“否”),理由是
乙同学认为:利用装置Ⅱ作简易改进(不改变仪器装置),可收集NO2气体,改进的方法是
丙同学认为:利用装置Ⅱ作简易改进(改变仪器装置),可收集NO2气体,改进的方法是
(2)利用装置Ⅰ、Ⅲ验证物质的性质(K2打开,K1关闭)。如设计实验证明氧化性:KMnO4>Cl2>Br2,则在A中加浓盐酸,B中加 ,C 中加 ,观察到C中的现象是 。



18.
 (6分)用5.0mol﹒L-1的NaOH溶液配制0.1mol﹒L-1的NaOH溶液时,如图所示的仪器中,肯定不需要的是_________(填序号),配制上述溶液还需要的玻璃仪器是___________________(填仪器名称)。
(6分)用5.0mol﹒L-1的NaOH溶液配制0.1mol﹒L-1的NaOH溶液时,如图所示的仪器中,肯定不需要的是_________(填序号),配制上述溶液还需要的玻璃仪器是___________________(填仪器名称)。
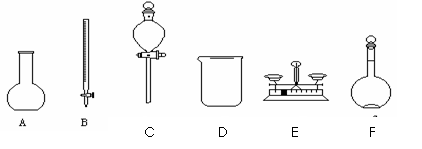








 (2)在配制过程中,下列操作将导致实际所配NaOH溶液浓度偏低的是(填编号)____________
(2)在配制过程中,下列操作将导致实际所配NaOH溶液浓度偏低的是(填编号)____________
 ①准确取出的浓NaOH溶液在空气中露置时间过长;
①准确取出的浓NaOH溶液在空气中露置时间过长;
 ②用量器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切;
②用量器将浓NaOH溶液直接加入容量瓶,缓慢加入蒸馏水至液面最低点恰好和环形刻度线相切;
 ③摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好和环形刻度线相切;
③摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好和环形刻度线相切;

 ④稀释NaOH溶液的仪器未洗涤。
④稀释NaOH溶液的仪器未洗涤。
17.硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用:
①Cu与稀硝酸反应制取:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2=2Cu(NO3)2+2H2O
下列说法正确的是
A.制取相同量的硝酸铜需硝酸的量③最多
B.制取相同量的硝酸铜①产生的有毒气体比②多
C.三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行
高三阶段性教学质量检测
化学试题
 第Ⅱ卷(非选择题 共54分)
第Ⅱ卷(非选择题 共54分)
16. 下列溶液中,各组离子一定能大量共存的是
下列溶液中,各组离子一定能大量共存的是
 A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
 B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
 C.碳酸氢钠溶液:K+、SO42-、Cl-、H+
C.碳酸氢钠溶液:K+、SO42-、Cl-、H+
 D.c(H+)=10-12
mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.c(H+)=10-12
mol·L-1的溶液:K+、Ba2+、Cl-、Br-
15. 在BaCl2溶液中通入SO2气体,溶液仍澄清。若将BaCl2溶液分盛到两个试管中,其中一支加入硝酸,另一支加入烧碱,然后再通入SO2气体,结果两支试管都要白色沉淀生成。由此得知下列结论合理的是
在BaCl2溶液中通入SO2气体,溶液仍澄清。若将BaCl2溶液分盛到两个试管中,其中一支加入硝酸,另一支加入烧碱,然后再通入SO2气体,结果两支试管都要白色沉淀生成。由此得知下列结论合理的是
 ①BaCl2有两性
②两支试管中生成的白色沉淀均是BaSO3
①BaCl2有两性
②两支试管中生成的白色沉淀均是BaSO3
 ③SO2有还原性其水溶液具有酸性 ④升高PH会使SO2水溶液中的SO32-浓度增大
③SO2有还原性其水溶液具有酸性 ④升高PH会使SO2水溶液中的SO32-浓度增大
 A.①②
B.②③
C.③④
D.①④
A.①②
B.②③
C.③④
D.①④
14. 要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验的最佳顺序为
要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验的最佳顺序为
 ①加入氯水 ②加入KMnO4溶液 ③加入NH4SCN溶液
①加入氯水 ②加入KMnO4溶液 ③加入NH4SCN溶液
 A.①③
B.③②
C.③①
D.①②③
A.①③
B.③②
C.③①
D.①②③
13. 用NA表示阿伏加德罗常数的值。下列叙述正确的是
用NA表示阿伏加德罗常数的值。下列叙述正确的是
 A.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
A.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
 B.标准状况下,22.4L 氨气中共价键数目为19NA
B.标准状况下,22.4L 氨气中共价键数目为19NA
 C.常温常压下的33.6L 氯气与27g铝充分反应,转移电子数为3NA
C.常温常压下的33.6L 氯气与27g铝充分反应,转移电子数为3NA
 D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
12. 下列反应的离子方程式正确的是
下列反应的离子方程式正确的是
 A.钠与水反应:Na+H2O=Na++OH-+H2↑
A.钠与水反应:Na+H2O=Na++OH-+H2↑
 B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
 C.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
C.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
 w.w.w.k.s.5
w.w.w.k.s.5
 D.用氯化铁溶液腐蚀电路板:Fe3++Cu=Fe2++Cu2+
D.用氯化铁溶液腐蚀电路板:Fe3++Cu=Fe2++Cu2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com