
15。下面是四种盐在不同温度下的溶解度(g/100gH2O)
|
温度 |
NaNO3 |
KNO3 |
NaCl |
KCl |
|
10℃ |
80.5 |
20.8 |
35.7 |
31.0 |
|
100℃ |
175 |
246 |
39.1 |
56.6 |
(假设:①盐类共存时不影响各自的溶解度。②分离晶体时,溶剂的损耗忽略不计。)
某同学设计用物质的量比为1:1的硝酸钠和氯化钾为原料,加入一定量的水制取硝酸钾的实验,其流程如图

(1) 在①和③的实验过程中,实验的关键条件是 ;
(2) 分离出晶体的②和④的操作是 (填倾倒、蒸发、结晶、过滤中的某种操作)。硝酸钾是晶体 (填A或C)。
(3) 粗产品中可能含有杂质离子是 ;检验方法是
;
(4) 欲将粗产品提纯,可采取的方法是 。
14.在配制一定量的物质的量浓度溶液时,下列操作使得到的溶液浓度偏高、偏低还是不变?
(1)用量筒筒取液态溶质读数时俯视量筒,所配溶液浓度 ;
(2)将取样品的药匙用水洗涤,洗涤液倒入容量瓶,所配溶液浓度 ;
(3)定容摇匀后,有少量溶液外流,所配溶液浓度 。
13.某硫酸盐RSO4在t℃时溶解度为31.75g。在t℃时取足量的RSO4饱和溶液,向其中加入8.00g RSO4后,析出24.6g RSO4·7H2O晶体,则R为 ( )
A.Zn B.Cu C.Fe D.Mg
12.某温度下,向盐A的饱和溶液(质量分数为a%)中加入m g无水盐A,同温下析出n g A·xH2O晶体,则从饱和溶液中析出的溶质质量为(设A式量为M) ( )
A.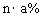 B.n-m
B.n-m
C.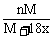 D.
D.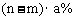
(注意由于温度不变,减少了的溶液也是该温度下的饱和溶液且饱和溶液的浓度不变)
11.有W1gKCl饱和溶液,其质量分数为C1%,采取某种措施后析出mgKCl晶体(不含结晶水),母液质量为W2g,质量分数为C2%。则下列关系正确的是 ( )
A.C1一定大于C2 B.W1·C1-W2·C2 =100m
C.W1 >W2 + m D.原条件下KCl的溶解度小于C1g
(注意对“某种措施”的讨论及溶质质量的恒定)
10.已知某饱和溶液的①溶液的质量(m液),②溶剂的质量(m剂),③溶液的体积(V液),④溶质摩尔质量(M质),⑤溶质溶解度(S质),⑥溶质的密度(ρ液)。以上条件的组合中,不能用来计算饱和溶液的物质的量浓度的是( )
A.①、②、③、④ B. ①、③、④、⑤
C. ④、⑤ 、⑥ D. ①、③、④
(本题重点考查溶质质量分数与物质的量浓度之间的换算,解题过程中注意其理解运用)
9.常温下将0.1mol下列物质分别投入90g水中充分混合,①CaO、②NaOH、③Na2O、④Na2O2。所得溶液质量分数排列顺序正确的是 ( )
A.③=④>②>① B.①>④=③>②
C.④>③>②>① D.③>④>②>①
(解题过程中注意氢氧化钙的微溶性)
8.在硫酸铜饱和溶液中,加入含示踪原子
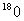 的白色硫酸铜粉末a g,维持温度不变,一段时间以后,再检验该溶液及溶液内取出的晶体,以下的结果正确的是( )
的白色硫酸铜粉末a g,维持温度不变,一段时间以后,再检验该溶液及溶液内取出的晶体,以下的结果正确的是( )
A.溶液内能找到含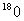 的硫酸根离子,取出的固体仍然为ag
的硫酸根离子,取出的固体仍然为ag
B.溶液内不含有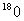 的硫酸根离子,取出的固体显蓝色,其质量为25a/16 g
的硫酸根离子,取出的固体显蓝色,其质量为25a/16 g
C.溶液内能找到含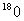 的硫酸根离子,取出的固体显蓝色,其质量为25a/16 g
的硫酸根离子,取出的固体显蓝色,其质量为25a/16 g
D.溶液内能找到含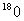 的硫酸根离子,取出的固体显蓝色,其质量必大于25a/16 g
的硫酸根离子,取出的固体显蓝色,其质量必大于25a/16 g
(本题主要考查溶解结晶平衡,注意加入的是无水化合物析出的是结晶水合物)
7.下列说法正确的是 ( )
A.一杯溶液里各部分性质不全相同,石灰乳是乳浊液
B.石碱加热后变成无水Na2CO3粉末,这样的过程叫风化;无水CaCl2、MgCl2 固体暴露在空气中能潮解
C.相同温度下,HCl比KNO3的溶解度大
D.相同温度下,100g水中最多能溶解的胆矾质量比无水CuSO4多
6.将淀粉KI混合液装在半透膜中,浸泡在蒸馏水的烧杯中一段时间后,某学生取烧杯中液体滴加几滴试剂便立即报告老师说:这个半透膜袋已经破损了,老师肯定了他的做法。这位学生所滴的试剂及观察到的现象是( )
A.滴两滴碘水显蓝色 B.滴淀粉试液显蓝色
C.滴入氯水-淀粉试液显蓝色
D.滴AgNO3溶液出现黄色沉淀
(本题主要考查胶体及碘单质的性质)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com