
2. Which of the following dates would probably be the opening date of Disneyland?
A. 1953 B. 1954 C. 1955 D. 1965
1. The passage is mainly about___________.
A. What visitors can enjoy in Disneyland.
B. The difficulties Disney met in building Disneyland
C. How Disneyland came into being
D. A brief introduction to Disneyland
25.(10分)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电 池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)负极反应式为 。
(2)电极表面镀铂粉的原因为 。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
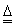 2LIH
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知用锂吸收224L(标准状况)H2,生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
24.(10分)实验室有一包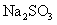 样品,可能含有
样品,可能含有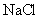 、
、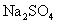 、
、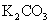 、
、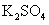 中
中
的一种或几种物质,为确定样品中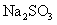 的质量分数和该样品的成分,进行如下实验:
的质量分数和该样品的成分,进行如下实验:
称取此样品6.30g,加入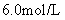 的硫酸至过量,产生无色气体
的硫酸至过量,产生无色气体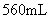 (标准状况)。
(标准状况)。
向逸出气体后的溶液中加入稍过量的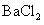 溶液,得到白色沉淀
溶液,得到白色沉淀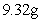 ,透过蓝色钴玻
,透过蓝色钴玻
璃观察,滤液的焰色反应无紫色。
请回答下列问题:
(1)若用下图所示仪器组装进行上述实验,正确的连接顺序是(填序号)__________;
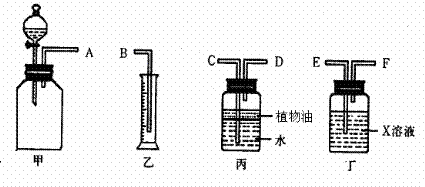
A.A→C→D→F→E→B B.A→D→C→E→F→B
C.A→F→E→C→D→B D.A→E→F→D→C→B
(2)丁装置中X溶液是__________;丙装置中植物油的作用是___________________;
(3)样品中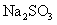 的质量分数为______________;
的质量分数为______________;
(4)若上述实验中加入硫酸溶液的体积为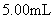 ,则该样品中一定还含有的物质是
,则该样品中一定还含有的物质是
_______________________。
23.(14分)
I.某同学欲测定硫酸铜晶体中结晶水的含量。他列出的实验用品为:硫酸铜晶体试样、研钵、坩埚、坩埚钳、酒精灯、三脚架、玻璃棒、药匙、托盘天平。 回答下面问题:
(1)完成本实验还需要的实验用品有 。
(2)下面的情况有可能造成测定结果偏低的是 (填序号)。
A.试样中含有易挥发的杂质 B.加热时有晶体溅出 ’
C.晶体加热脱水不完全 D.实验前坩埚未完全干燥 E.硫酸铜受热分解
Ⅱ.该同学发现硫酸铜晶体加热后变黑,查阅资料得知:硫酸铜在加热条件下生成CuO、SO2、O2、SO3。现用下图所示的装置验证硫酸铜在加热分解时有SO2产生,并测量产生的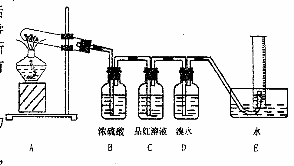 O2的体积。
O2的体积。
试填写下列空白:
(1)硫酸铜受热分解的化学方程式 为 。
(2)装置B的作用是 ,
(3)停止加热时,测量收集到的气体体积必须包括以下几步:
① ; ②调整量筒内外液面高度使之相同;
③读取量筒内气体的体积。
(4)Y为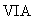 族元素构成的气态单质,将Y和SO2分别通人品红溶液,都能使品红溶液褪色。则Y的化学式为
;简述区别二者的实验方法
。
族元素构成的气态单质,将Y和SO2分别通人品红溶液,都能使品红溶液褪色。则Y的化学式为
;简述区别二者的实验方法
。
22、(12分)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的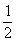 ,Y元素最高正价与它的负价代数和为6。M与其它物质的转化关系如下(部分产物已略去):
,Y元素最高正价与它的负价代数和为6。M与其它物质的转化关系如下(部分产物已略去):
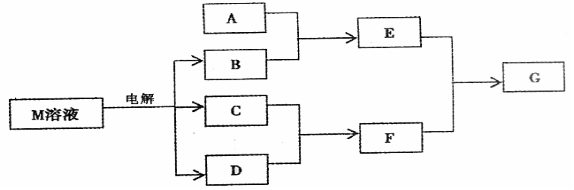 (1)若A是与X、Y同周期的一种常见金属单质,则A与B溶液反应的化学方程式是: ;
(1)若A是与X、Y同周期的一种常见金属单质,则A与B溶液反应的化学方程式是: ;
(2)若A是一种常见酸性氧化物,且可用于制造玻璃,则E与F反应的离子方程式是: ;
(3)若A是一种常见的化肥,式量为79,且E和F生成G时有白烟生成,则A和足量B反应的离子方程式___________________________,G的电子式_______
21.(14分)元素周期表揭示了许多元素的相似性和递变规律。同一周期构成的某些微粒往往具有相同的电子数,如周期表中主族元素可以构成许多电子数为10或18的微粒。下列周期表中列出一些均与对应元素有关的18电子微粒。
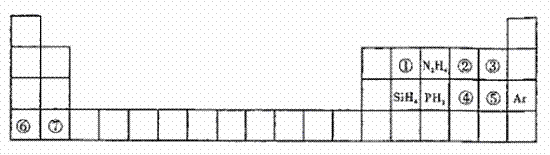
(1)①为8核微粒,其名称为_________;②的电子式____________,PH3的空间构型为______
(2)④⑤⑥⑦对应元素形成的简单离子半径从小到大的顺序为__________________(用离子符号表示)。
(3)写出③参加的置换反应的化学方程式___________________。
(4)④对应的某种18电子的离子与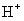 和
和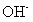 均可发生反应,写出其与OH-反应的离子方程式:_____________________________
均可发生反应,写出其与OH-反应的离子方程式:_____________________________
(5)在火箭推进器中装有液态N2H4和液态②,已知0.4mol液态N2H4和足量液态②反应,生成一种气态单质和气态氢化物,放出256.6kJ的热量,则该反应的热化学方程式为________________________________________。
20.硝酸与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH4+中的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中逐滴加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质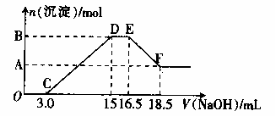 的量的关系如下图,则下列说法中不正确的是( )
的量的关系如下图,则下列说法中不正确的是( )
A.与HNO3反应后,Fe元素的化合价为+3
B.D→E段反应的离子方程式为
NH4++OH-=NH3·H2O
C.纵坐标A点数值为0.008
D.纵坐标B点数值为0.012
第Ⅱ卷
19.X、Y、Z、W四种主族元素均在短周期,且原子序数依次增大。已知X、Z两元素原子的最外层电子数均为其电子层数的2倍;Y、W的最外层电子数相同。下列说法中正确的是( )A.X、Z两元素的氢化物分子中均含4对共用电子对
B.Y、Z、W均可分别与X形成非极性分子
C.Y的氢化物沸点比W的氢化物沸点低
D.Y的单质可与冷水反应并置换出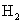
18.下列实验操作中,正确的是
①准确称取4.0g的NaOH固体溶于1L水配成浓度为1.0 mol·L-1的溶液
②用10 mL 量筒量取5.2mL盐酸
③用蒸发皿加热NaCl溶液可以得到NaCl晶体
④用100 mL容量瓶稀释18mol•L-1浓 H2SO4溶液
⑤用带玻璃塞的棕色试剂瓶存放浓HNO3
⑥中和热测定的实验中使用的玻璃仪器只有2种
⑦将一小块pH试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸
上,再与标准比色卡对照
A.②④⑦ B.②⑤⑥
C.②③⑤ D.①②③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com