
6.已知集合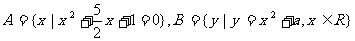 ,若
,若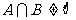 ,则
,则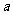 的取值范围是
( )
的取值范围是
( )
A.  B.
B.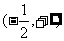 C.
C.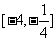 D.
D.
5.“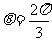 ”是“
”是“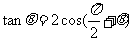 ”的
( )
”的
( )
A. 必要不充分条件 B. 充分不必要条件 C.充要条件 D.既不充分也不必要条件
4.不等式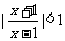 的解集为
( )
的解集为
( )
A.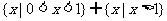 B.
B. 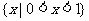
C. 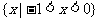 D.
D.
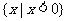
3. 已知函数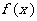 是定义在R上的奇函数,当
是定义在R上的奇函数,当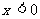 时,
时,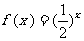 ,则
,则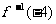 的值是( )
的值是( )
A.2
B.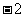 C.3
D.
C.3
D.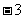
2.若不等式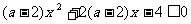 对一切
对一切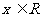 恒成立,则
恒成立,则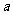 的取值范围是 ( )
的取值范围是 ( )
A. B.
B.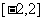 C.
C.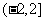 D.
D.
1.已知函数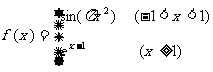 ,若
,若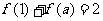 ,则
,则
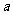 的所有可能值为( )
的所有可能值为( )
A.1
B.1或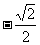 C.
C.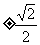 D. 1或
D. 1或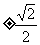
37.(8分)
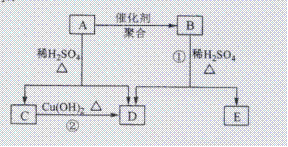
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧.A的相关反应如下图所示:
已知R-CH=CHOH(烯醇)不稳定,很快转化为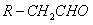 。
。
根据以上信息回答下列问题:
(1)A的分子式为 ;
(2)反应②的化学方程式是 ;
(3)A的结构简式是 ;
(4)反应①的化学方程式是
;
(5)A有多种同分异构体,其中与A具有相同官能团的同分异构体(不包括A)共有______种
(6)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为
河北衡水中学2009-2010学年度小学期调研考试
36.(10分)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
I 从废液中提纯并结晶处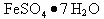 。
。
II将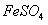 溶液与稍过量的
溶液与稍过量的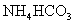 溶液混合,得到含
溶液混合,得到含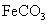 的浊液
的浊液
IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到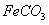 固体
固体
V煅烧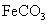 ,得到
,得到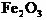 固体
固体
已知: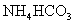 在热水中分解
在热水中分解
(1) I中,加足量的铁屑出去废液中的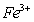 ,该反应的离子方程式是
,该反应的离子方程式是
(2)
III中,生成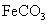 的离子方程式是
。若
的离子方程式是
。若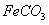 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
(3) IV中,通过检验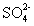 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验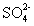 操作是是
操作是是
(4) 已知煅烧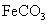 的化学方程式是
的化学方程式是 ,现煅烧464.0kg的
,现煅烧464.0kg的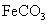 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有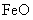 ,则该产品中
,则该产品中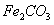 的质量是
kg(摩尔质量/g·
的质量是
kg(摩尔质量/g·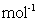 :
: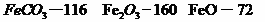 )
)
35.(8分)下图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g5.00%nNaOH溶液、足量的CuSO4溶液和100g9.55%的K2SO4溶液,电极均为石墨电极。
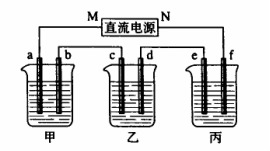
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.00%,乙中c电极质量增加,据此回答问题:
⑴电源的N端为__________________极
⑵电极b 上发生的电极反应为_______________________________________________
⑶列式计算电极b上生成的气体在标状况下的体积______________________________
⑷电极c的质量变化是________________g
34. (7分)以黄铁矿为原料生产硫酸的工艺流程图如下:
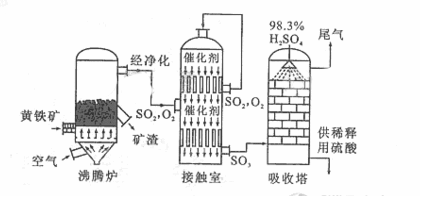
(1)将燃烧黄铁矿的化学方程式补充完整
4 +11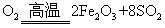
(2)接触室中发生反应的化学方程式是 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a. 为使黄铁矿充分燃烧,需将其粉碎
b. 过量空气能提高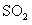 的转化率
的转化率
c. 使用催化剂能提高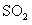 的反应速率和转化率
的反应速率和转化率
d. 沸腾炉排出的矿渣可供炼铁
(4)每160g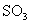 气体与
气体与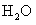 化合放出260.6kJ的热量,该反应的热化学方程是 。
化合放出260.6kJ的热量,该反应的热化学方程是 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的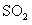 和铵盐。
和铵盐。
①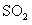 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的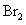 。
。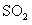 吸收
吸收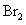 的离子方程式是
。
的离子方程式是
。
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的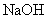 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %; 若铵盐质量为15.00g。 浓硫酸增加的质量为 。 (计算结果保留两位小数)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com