
3.(安徽2008-2009萧城一中第四次月考)Cu(NO3)2受热分解后的产物为不含氮元素的固体、NO2和O2,CuO在一定温度下可发生下列反应: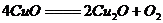 ,试回答下列问题:
,试回答下列问题:
(1)若Cu(NO3)2受热分解后生成的NO2和O2的物质的量之比为4:1,则铜元素的化合价在分解前后是否发生了变化___________(填“改变”或“不变”),其理由是__________________________________________________________________________
(2)若称到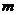
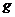 Cu(NO3)2强热使其分解得到NO2和O2,还有
Cu(NO3)2强热使其分解得到NO2和O2,还有
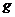 固体。将气体用水充分吸收后还有残余气体同时得到100
固体。将气体用水充分吸收后还有残余气体同时得到100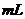 溶液,则该溶液物质的量浓度为_________mol.L-1(用含
溶液,则该溶液物质的量浓度为_________mol.L-1(用含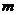 的式子表示)。
的式子表示)。
(3)若(2)中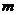 =3.76
=3.76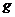 ,
,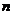 =1.52
=1.52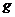 ,试通过计算求残留固体的成分及其质量。
,试通过计算求残留固体的成分及其质量。
[解析](1)不变,因为Cu(NO3)2分解生成的NO2和O2的物质的量比为4:1,则氮元素得电子数与氧元素失电子数相等,所以反应前后Cu元素的化合价不变。(4分)
(2)0.106m (或5m/47) 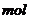 ·L-1 (3分)
·L-1 (3分)
(3)3.76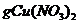 的物质的量为
的物质的量为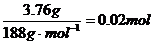 ,若分解得到的固体产物全部为
,若分解得到的固体产物全部为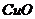 ,则m(残渣)=
,则m(残渣)=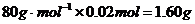 ,若
,若
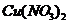 分解生成的残渣为
分解生成的残渣为 ,则m(残渣)=
,则m(残渣)=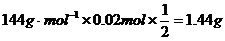
而现在质量为1.52g,则残渣成分为 和
和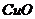 的混合物,依题意得:
的混合物,依题意得: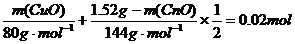
解之得
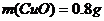 ,
,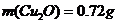
(其它合理过程也给分)
[答案]见解析
2.(安徽蚌埠市凤阳中学09届高三第四次月考)在密闭容器中,将0.020 mol·L-1 CO和H2O(g)混合加热到773K时,达到下列平衡CO(g)+H2O(g)  CO2(g)+H2(g),已知该反应的K = 9,求CO的平衡浓度和转化率。
CO2(g)+H2(g),已知该反应的K = 9,求CO的平衡浓度和转化率。
[解析]设CO的转化浓度为x mol·L-1,则
CO(g) + H2O(g)  CO2(g) + H2(g)
CO2(g) + H2(g)
起始浓度(mol·L-1) 0.020 0.020 0 0
转化浓度(mol·L-1) x x x x
平衡浓度(mol·L-1)0.020-x 0.020-x x x
将平衡浓度数值代入平衡常数表达式中得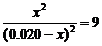 ,(2分)解得x=0.0150。
,(2分)解得x=0.0150。
因此平衡时CO的浓度为0.020-x=0.005 mol·L-1,其转化率为α(CO) = 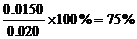
[答案][CO]=0.005 mol·L-1 α(CO)=75%
1.(浙江09届高三化学第一学期期末考试)下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:
2H2O(l)=2H2(g)+O2(g);△H=+285.5 kJ·mol-1
B.已知2C(石墨,s)+O2(g)=2CO(g);△H=-221 kJ·mol-1,
则石墨的燃烧热为110.5 kJ·mol-1
 C.已知N2(g)+3H2(g) 2 NH3(g)
;△H=-92.4 kJ·mol-1,则在一定条件下将
C.已知N2(g)+3H2(g) 2 NH3(g)
;△H=-92.4 kJ·mol-1,则在一定条件下将
1molN2和3molH2置于一密闭容器中充分反应后,最多可放出92.4kJ的热量
D.已知乙醇和乙烯的燃烧热分别为1366.8kJ·mol-1和1411.0 kJ·mol-1,
则乙烯水化制乙醇的热化学方程式为:
C2H4(g)+H2O(l)=C2H5OH(l);△H=-44.2kJ·mol-1
[解析]氢气的燃烧热为285.5 kJ·mol-1, 则2H2O(l)=2H2(g)+O2(g);△H=+571 kJ·mol-1,A错;B错,因为燃烧热是指1mol可燃物完全燃烧生成稳定常温常压氧化物放出的热量;
C错,由于反应不能进行彻底,放出的热量一定小于92.4kJ;D正确,根据盖斯定律可以知道。
[答案]D
11.(皖南八校2009届高三第二次联考12月)一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+ 3H2O==2NH3+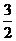 O2.
O2.
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
|
T/℃ |
30 |
40 |
50 |
生成NH3量/(10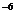 mo1) mo1) |
4.8 |
5.9 |
6.0 |
 请回答下列问题:21世纪教育网
请回答下列问题:21世纪教育网
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为 mol/min。
(2)该反应过程与能量关系可用右图表示.完成反应的热化学方程式: 。
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(4)工业合成氨的反应为N2(g)+3 H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
① 该条件下反应2NH3(g) N2(g)十3H2(g)的平衡常数为
。
N2(g)十3H2(g)的平衡常数为
。
② 相同条件下,在另一相同容器中充人a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.8 mo1,H2为2.0 mol,则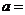 ,
,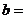 。
。
[解析](1)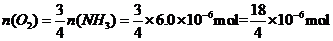
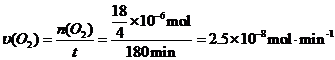
(4)① N2(g)+ 3H2(g) 2NH3(g)
2NH3(g)
起始 /mol 0.80 1.60 0
/mol 0.80 1.60 0
转化 /mol
/mol 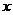 3
3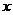 2
2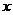
平衡n/mol 0.80-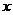 1.60一3
1.60一3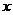 2
2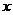
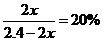
解得: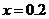
则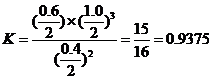
② 由温度相同知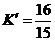 设平衡时N2物质的量为
设平衡时N2物质的量为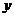
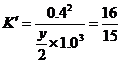
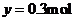
由等效转化可求起始时N2、H2的物质的量。
[答案](1)2.5×l0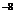
(2)N2(g)+3H2O(1)=2NH3(g)+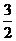 O2(g)
O2(g) 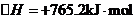
(3)升高温度;加压;不断移出生成物脱离反应体系(合理均可)
(4)①0.9375 ②0.7 3. 2
[专题综合]
10.(安徽省2009届合肥市高三一摸.23)数据分析能力是新课程中对学生提出的一项要求。下表是用沉淀法测定KHCO3和Na2CO3混合物的组成的相关数据。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
|
实验 次数 |
称取样品的质量/g |
所加Ba(OH)2溶液的体积/L |
测得生成沉淀质量/g |
|
1 |
0.518 |
0.5 |
0.985 |
|
2 |
1.036 |
0.5 |
|
|
3 |
1.554 |
0.5 |
2,955 |
|
4 |
2.072 |
0.5 |
3.940 |
|
5 |
2.590 |
0.5 |
3.940 |
|
6 |
3.108 |
0.5 |
3.940 |
分析上表数据回答下列问题:21世纪教育网
(1)第2次实验中产生沉淀质量是多少克,请将结果填在表格相应空格中;
(2)样品中KHCO3和Na2CO3的物质的量之比是 ;
(3)室温下,取上述Ba(OH)2溶液50mL,加入0.05moL/L的盐酸,反应后所得溶液的pH=2,求出所加盐酸的体积(溶液混合时不考虑体积变化,写出计算过程)。
[解析](1)1-3次中固体完全反应,4-6次实验中Ba(OH)2完全反应,Ba(OH)2溶液过量,根据比例关系,0.518g:0.985g=1.036g:m,m=1.970g ;
(2)根据第一次实验数据:100n(KHCO3)+106n(Na2CO3)=0.518g, n(KHCO3)+n(Na2CO3)= 0.985/197mol, n(KHCO3)= 0.002mol ,n(Na2CO3)= 0.003mol, n(KHCO3):n(Na2CO3)=2:3.
(3)根据第4次实验数据:C(Ba(OH)2)=[3.940/197]mol/0.5L=0.04mool/L,C(OH-)=0.08mol/L
[V(HClaq) ×0.05moL/L-0.05L×0.08mol/L ]/ [V(HClaq) -0.05L]=0.01mol/L ;
V(HClaq)=112.5ml。
[答案](1)1.970g ;(2)2:3;(3)112.5ml
9.(08南通最后)以CO、H2和CH2=CH2为原料,利用上题信息,通过反应①可制取丙醛, 丙醛经反应②(加氢加成)可生成正丙醇、经反应③(催化氧化)可生成丙酸。由正丙醇和丙酸经反应④(酯化反应)生成丙酸正丙酯。请通过计算回答下列问题:
⑴ 理论上生产3.0 kg正丙醇至少需要标准状况下的氢气 L;
⑵ 由于副反应的发生,生产中反应①、反应②、反应③的产率分别为a、a、b,且a<b。若反应④中反应物转化率均为70%。则(计算结果请用含a、b的代数式表示):
① 以2.8×103kg乙烯为原料,当反应②、反应③中丙醛的投料比为1∶1时,通过上述4步反应最多可制得丙酸正丙酯 kg;
② 反应④中增加正丙醇的投料并保持正丙醇的转化率不变,可以使丙酸的转化率提高20%,此时反应②和反应③中丙醛的投料比应为多少?
[解析](1)略,(2) ② 设反应②中丙醛的物质的量为x,反应③中丙醛的物质的量为y
则:CH3CH2CHO+H2→CH3CH2CH2OH
x ax
2CH3CH2CHO+O2→2CH3CH2COOH
y by
根据CH3CH2CH2OH+CH3CH2COOH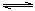 CH3CH2COOCH2CH2CH3+H2O
CH3CH2COOCH2CH2CH3+H2O
可知,当丙酸的转化率增加20%时,消耗的丙醇应为by(0.7+0.2)=0.9 by
应有:0.7 ax=0.9 by
即: x∶y=9b∶7a
[答案]⑴ 2.24×103 ⑵ ① 4.06a2 ② 9b∶7a
8.(上海黄浦区08化学模拟)取标准状况下CH4和过量O2的混合气体840 mL,点燃,将燃烧后的气体用过量碱石灰吸收,碱石灰增重0.600 g。
(1) 计算碱石灰吸收后所剩气体的体积(标准状况下)。
(2) 计算原混合气体中CH4跟O2的体积比。
[解析] (1) CH4+2O2→CO2+2H2O 1 mol CH4完全燃烧得到的CO2和H2O共 80 g
原混合气体中n(CH4)=
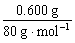 =0.0075 mol
=0.0075 mol
CH4体积为0.0075 mol×22.4×103 mL·mol-1=168 mL
剩余气体的体积=840 mL-3×168 mL=336 mL
(2)V(CH4)∶V(O2)=168∶(840-168)=168∶672=1∶4
[答案](1)336 mL (2) 1∶4
7.(2009年上学期绍兴中学学科综合检测试题)在t℃时,某Ba(OH)2的稀溶液中c(H+)=10-a mol/L,c(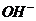 )=10-b
mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如下表所示。
)=10-b
mol/L,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如下表所示。
|
序号 |
Ba(OH)2溶液的体积 / mL |
盐酸的体积 / mL |
溶液的pH |
|
① |
22.00 |
0.00 |
8 |
|
② |
22.00 |
18.00 |
7 |
|
③ |
22.00 |
22.00 |
6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A.3 B.4 C.5 D.6
[解析]由题意,在t℃时,Kw=1×10-12,②碱过量,PH=8,C(OH-)=10-4mol/L
22×10-b-18.00×10-C=40×10-5 , ③恰好完全反应,22×10-b=22×10-C ,联立两个等式,c=4.
[答案]B
6.(安徽省砀山中学2009届高三化学试卷)某结晶水合物的化学式为A·H2O,其相对分子质量为B,在60℃时m g 该晶体溶于ng水中,得到v mL 密度为d g· mL-1 的饱和溶液,下述表达式或判断正确的是( )
A.该溶液物质的量浓度为(1000m/BVd)mol·L-1
B.60℃时A 的溶解度为(100m(B-18)/nB)g
C. 该溶液溶质的质量分数为(m/(m+n))×100% ,
D.60℃时,将10g A 投入到该饱和溶液中,析出晶体大于l0g
[解析]n(A·H2O)=n(A)= m/B mol;C(A)=1000n(A)/V=1000m/VB mol/L,A错;
晶体中A的质量是:m(B-18)/B ,根据饱和溶液的概念S:100= m(B-18)/B :(n+18 m/B),则B错;该溶液溶质的质量分数为(m(B-18)/ B (m+n))×100% ,C错;
由于10g A加入,A+H2O=A·H2O,D正确21世纪教育网
[答案]D
5.(2009福建模拟题)设NA为阿伏加德罗常数,下列说法正确的是( )
A.0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA
B.1mol H2O2完全分解生成H2O和O2时,转移了NA个电子
C.1mol C10H22分子中,含有共价键数目为32NA
D.0.5mol Na2O2中含有NA个阴离子
[解析]Fe与Cl2反应生成FeCl3,Fe过量,转移电子数小于0.3NA,A项不正确;H2O2完全分解时,是1mol负1价氧失电子,另外1mol负1价得电子,转移电子为1mol,B项正确;1mol C10H22分子中含共价键数目为(22+10-1)NA,即31NA,C项不正确;0.5mol Na2O2含有0.5NA个O2-2(阴离子)。
[答案]B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com