
7.(09宁夏卷7) 将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为
A.NO2 B.N2O2 C.N2O D.N2O4
 [解析]根据2NxOy+2yCu=2yCuO+xN2,以及题中数据反应后气体体积为反应前气体体积的一半,可以得到x=1,因此只有A选项符合题意。
[解析]根据2NxOy+2yCu=2yCuO+xN2,以及题中数据反应后气体体积为反应前气体体积的一半,可以得到x=1,因此只有A选项符合题意。
[答案]A
[考点分析]本题考查物质的量应用于化学方程式的计算,通过体积变化确认物质化学式。
6.(09福建卷 8)设NA为阿伏伽德罗常数,下列叙述正确的是
8)设NA为阿伏伽德罗常数,下列叙述正确的是
 A.24g镁的原子量最外层电子数为NA B.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
A.24g镁的原子量最外层电子数为NA B.1L0.1mol·L-1乙酸溶液中H+数为0.1NA
 C.1mol甲烷分子所含质子数为10NA D.标准状况下,22.4L乙醇的分子数为NA
C.1mol甲烷分子所含质子数为10NA D.标准状况下,22.4L乙醇的分子数为NA
[解析]A项,镁的最外层电子数为2,故错;B项,乙酸为弱电解质,部分电离,故H+小于0.1NA,错;C项,CH4的质子数为10,正确;D项,乙醇标状下不是气体,错。
[答案]C
[考点分析]本题借助于阿伏伽德罗常数的计算考查物质的量与其他物理量之间的关系。
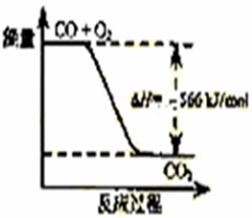
5.(09天津卷 6)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
6)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
 Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+
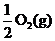 ΔH=-226kJ/mol
ΔH=-226kJ/mol
 根据以上热化学方程式判断,下列说法正确的是
根据以上热化学方程式判断,下列说法正确的是
 A.CO的燃烧热为283 kJ
A.CO的燃烧热为283 kJ
 B.右图可表示由CO生成CO2的反应过程和能量关系
B.右图可表示由CO生成CO2的反应过程和能量关系
 C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452
kJ/mol
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452
kJ/mol
 D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
[解析]A项,燃烧热的单位出错,应为Kj/mol,错;
图中的量标明错误,应标为2molCO和2molCO2,故错。
CO2气体的能量大于固体的能量,故C项中放出的能量应小于452KJ,而H用负值表示时,则大于-452Kj/mol,正确;
将下式乘以2,然后与上式相加,再除以2,即得CO与Na2O2的反应热,所得热量为57KJ,故D项错21世纪教育网
[答案]C
[考点分析]本题主要考查化学反应与能量变化,具体考查燃烧热、能量变化图、热化学反应方程式、能量计算;
2.(09全国卷Ⅰ11)为了检验某含有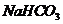 杂质的
杂质的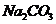 样品的纯度,现将
样品的纯度,现将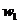 克样品加热,其质量变为
克样品加热,其质量变为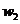 g,,则该样品的纯度(质量分数)是
g,,则该样品的纯度(质量分数)是
A.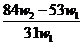 B.
B.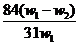 C.
C.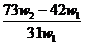 D.
D.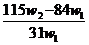
[解析]2NaHCO3
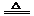 Na2CO3 + CO2↑
+ H2O m (减少)
Na2CO3 + CO2↑
+ H2O m (减少)
2×84 106 62
x (w 1- w2)
解得 x=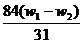 ,将其带入下式可得: w(Na2CO3)= (w1- x )/ w1 =
,将其带入下式可得: w(Na2CO3)= (w1- x )/ w1 = 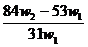 ,A项正确21世纪教育网
,A项正确21世纪教育网
[答案]A
[考点分析]本题考查质量分数的计算,同时考查学生差量法的使用技巧。
3.(09全国卷Ⅱ
 10)现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳
10)现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳
酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是

 A.④①②⑤⑥③ B.④①②⑥⑤③
A.④①②⑤⑥③ B.④①②⑥⑤③ 
 C.①④②⑥③⑤ D.①④②③⑥⑤
C.①④②⑥③⑤ D.①④②③⑥⑤
[解析] ①②④均属于酸,其中醋酸最强,碳酸次之,苯酚最弱。③⑤⑥均属于强碱弱酸盐,根据越弱越水解的原理知,因H2CO3>苯酚>HCO3- ,所以对应的盐,其碱性为:碳酸钠>苯酚钠>碳酸氢钠,pH顺序相反,故C项正确。
[答案]C
[考点分析]本题考查溶液pH的大小比较;
4.(09全国卷Ⅱ12)




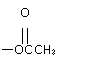

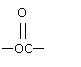

 1 mol HO 与足量的NaOH
1 mol HO 与足量的NaOH




 溶液充分
溶液充分
反应,消耗的NaOH的物质的量为

 A.5 mol
B.4 mol
C.3 mol
D.2 mol
A.5 mol
B.4 mol
C.3 mol
D.2 mol
[解析] 该有机物含有酚,还有两个酯基,要注意该有机物的酯基与NaOH水解时,生成羧酸钠,此外生成的酚还要继续消耗NaOH,故需要5molNaOH,A项正确。
[答案]A
[考点分析]本题考查有机物的官能团消耗氢氧化钠的量的关系。
1.(09全国卷Ⅰ7) 将15ml.2mol•.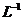
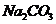 溶液逐滴加入到40 ml.0.5mol•.
溶液逐滴加入到40 ml.0.5mol•.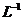
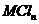 盐溶液中,恰好将溶液中的
盐溶液中,恰好将溶液中的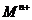 离子完全沉淀为碳酸盐,则
离子完全沉淀为碳酸盐,则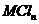 中n值是
中n值是
A.4 B3 C. 2 D. 1
[解析]M的化合价为+n,Na2CO3与MCln反应对应的关系式为:2Mn+ ~ nCO32 -
2 n
15×10-3×2 40×10-3×0.5
可得n=3,故选B21世纪教育网
[答案]B
[考点分析]本题考查物质的量应用于化学方程式的计算;
3. 对于计算类的题目最基本的方法就是要弄清计算该问题的基本计算公式是什么,题给物理量有什么,还缺什么物理量21世纪教育网
[典例精析]
2. 平时注意计算题技巧和方法的归纳,提高解题的速度;
1. 熟练掌握考纲中涉及计算的知识点;
28、某化学反应2A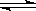 B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
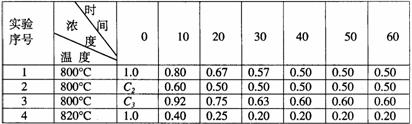
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
27.Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+ 2Fe2++I2(水溶液)。
(1)在一定温度下,测得2min内生成I2的浓度为0.02mol/L,则用Fe3+表示该反应在这2min内平均反应速率为________________。
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K{c(I-)}m{c(Fe3+)}n(K为常数)
2Fe2++I2(水溶液)。
(1)在一定温度下,测得2min内生成I2的浓度为0.02mol/L,则用Fe3+表示该反应在这2min内平均反应速率为________________。
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K{c(I-)}m{c(Fe3+)}n(K为常数)
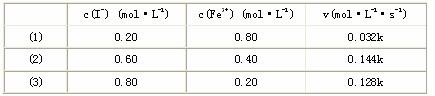
通过所给的数据计算得:在v=K{c(I-)}m{c(Fe3+)}n中。m、n的值为________________[选填(A)、(B)、(C)、(D)。 A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2 I-浓度对反应速率的影响________________Fe3+浓度对反应速率的影响。(选填:小于、大于、等于)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com