
【题目】氮的氧化物(如NO2、N2O4、N2O5等)应用很广,在一定条件下可以相互转化。
(1)已知:N2O5在一定条件下发生分解2N2O5(g) ![]() 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
T/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol·L-1 | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0,第2.00 min时体系压强为p,则p∶p0=________;1.00~3.00 min内,O2的平均反应速率为________。
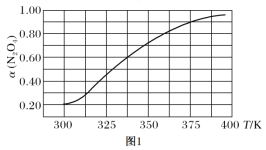
(2)在N2O4与NO2之间存在反应:N2O4(g)![]() 2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
①337.5 K时,反应的平衡常数K=________(填写计算结果)。
②据图推测N2O4(g) ![]() 2NO2(g)是吸热反应,理由是_______________。
2NO2(g)是吸热反应,理由是_______________。
③对于反应N2O4(g)![]() 2NO2(g),用平衡时各组分压强关系表达的平衡常数
2NO2(g),用平衡时各组分压强关系表达的平衡常数![]() 。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。
。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。
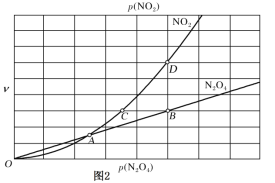
【答案】1.75 0.090 mol/( L·min) 3.6 温度升高,α(N2O4)增加,说明平衡向正反应移动 k2Kp/2 B点与D点,v(NO2消耗)=2v(N2O4消耗)= v(NO2生成)满足平衡条件
【解析】
(1)2N2O5(g) ![]() 4NO2(g)+O2(g)
4NO2(g)+O2(g)
起始:1 0 0
变化:0.5 1 0.25
2min:0.5 1 0.25 相同条件下,压强之比等于物质的量之比,p/p0=(0.5+1+0.25)/1=1.75;根据化学反应速率数学表达式,v(N2O5)=(0.71-0.35)mol·L-1/2min=0.18mol/(L·min),根据化学反应速率之比等于化学计量数之比,即v(O2)=v(N2O5)/2=0.090mol/(L·min);
(2)①N2O4(g)![]() 2NO2(g)
2NO2(g)
起始: 1 0
平衡: 0.4 1.2 根据化学平衡常数的表达式,K=c2(NO2)/c(N2O4)=1.22/0.4=3.6;
②根据图1,随着温度升高,N2O4转化率增大,反应向正反应方向移动,根据勒夏特列原理,该反应正反应为放热反应;
③Kp的表达式为Kp=[p(NO2]2/p(N2O4),当反应达到平衡时,2v(N2O4)=V(NO2),把公式代入,推出:k1=Kp·k2/2;v(NO2消耗)=2v(N2O4消耗)= v(NO2生成)满足平衡条件,即平衡点为B点和D点。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.少量的SO2通入到Ca(ClO)2溶液中:Ca(ClO)2 + SO2 + H2O ═ CaSO3↓+ 2HClO
B.室温下,测得氯化铵溶液pH<7,因为NH4+ + 2H2O NH3·H2O + H3O+
C.吸氧腐蚀负极的电极反应式为:Fe - 3e- ═ Fe3+
D.用碳酸氢钠溶液检验水杨酸中的羧基: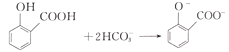
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化四磷用于制造火柴即火柴盒摩擦面,分子结构如图所示。下列有关三硫化四磷的说法正确的是( )
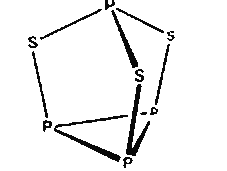
A. 该物质中磷元素的化合价为+3
B. 22 g P4S3含硫原子数目约为1.806×1023
C. 该物质分子结构中S、P最外层电子数均不为8
D. 该物质分子中全是极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告中指出,“大力保障和改善民生,让广大人民群众病有所医、老有所养。”茜草素H(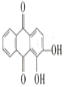 )对金黄色葡萄球菌的生长有抑制作用,一种合成茜草素的线路设计如下:
)对金黄色葡萄球菌的生长有抑制作用,一种合成茜草素的线路设计如下:
请回答下列问题:

已知: 
(1)H中所含官能团的名称是__________________,C的名称是_________________。
(2)A→B反应类型是_______________。C→D反应类型是_______________。
(3)写出C→D的化学方程式:______________________________________________________。
(4)G的结构简式为____________X是A的加聚产物,则其顺式结构的结构简式为__________。
(5)写出E与乙二醇的缩聚反应的化学方程式:_____________________________________。
(6)芳香族化合物Y是B的同分异构体,同时符合下列条件的Y共有_______种。
A.1 mol Y能消耗 1 mol NaOH B.Y能与FeCl3溶液发生显色反应
C.苯环上有3个取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①金属氧化物一定是碱性氧化物 ②碱性氧化物一定是金属氧化物
③酸性氧化物一定是非金属氧化物 ④非金属氧化物不一定是酸性氧化物
⑤能电离出![]() 的化合物一定是酸 ⑥
的化合物一定是酸 ⑥![]() 属于一元酸
属于一元酸
⑦含有氧元素的化合物都是氧化物 ⑧酸性氧化物不一定能与水化合生成酸
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿(主要成分:FeS2和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:
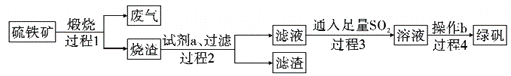
下列说法不正确的是( )
A. 过程1,废气中含SO2
B. 过程2,试剂a为稀硫酸
C. 过程3,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D. 过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种元素在周期表中的位置如下图所示,已知A、B、C原子序数之和为37。下列关于A、B、C三种元素的说法正确的是
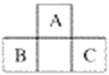
A. 元素B和C位于第四周期 B. 元素A的原子序数为7
C. 元素B最外层有5个电子 D. 元素C位于第三周期ⅤA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。
I.实验室通过如图所示装置制备Na2S2O3
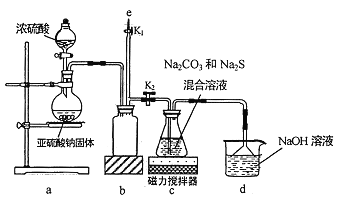
(1)实验中要控制SO2生成速率,可采取的措施有_____________(写出一条)。
(2)b装置的作用是_____________ 。
(3)反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为__________(填化学式)。
(4)实验结束后,在e处最好连接盛__________(填“NaOH 溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______________,最后拆除装置。
II.氰化钠废水处理
(5)已知: a.废水中氰化钠的最高排放标准为0.50mg/L;
b.Ag++2CN-==[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。
实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用________(填仪器名称) 盛装; 滴定终点时的现象是______________。
②处理后的废水是否达到排放标准_______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A. 图Ⅰ所示电池中,锌为负极,MnO2的作用是催化剂
B. 图II所示电池二氧化铅为正极,放电过程中硫酸浓度不变
C. 图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图IV所示电池工作过程中,Ag2O是氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com