
| 36g |
| 18g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
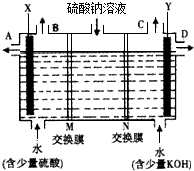
 已知H2O2的分子空间结构可在二面角中表示,如图所示,则有关H2O2的结构的说法中不正确的是( )
已知H2O2的分子空间结构可在二面角中表示,如图所示,则有关H2O2的结构的说法中不正确的是( )| A、分子的正、负电荷重心不重合 |
| B、H2O2分子内既含极性键又含非极性键 |
| C、H2O2是极性分子 |
| D、H2O2分子间不可能形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO2
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO2| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 正极 | 负极 | 电解质溶液 | |
| A | Zn | Cu | CuCl2 |
| B | Cu | Zn | H2SO4 |
| C | Cu | Zn | CuSO4 |
| D | Zn | Fe | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
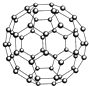
| A、28 g N60单质(见如图)中含有的N-N键键数为3NA |
| B、常温常压下,28 g C2H4和C3H6的混合气体中含有碳原子的数目为2NA |
| C、一定温度下,1 L0.5mol/L 的NH4Cl溶液与2 L 0.25 moL/L NH4Cl溶液含NH4+数目相等 |
| D、含有2NA个阴离子的CaC2在标准状况下,能产生约44.8L的乙炔气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
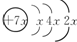 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个单电子,E的外围电子排布式为3d64s2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 钾的化学性质非常活泼在氧气中燃烧能生成 超氧化钾晶体(KO2),其结构如图所示为该晶体的一个晶胞(晶体中最小重复单元).下列有关说法正确的是( )
钾的化学性质非常活泼在氧气中燃烧能生成 超氧化钾晶体(KO2),其结构如图所示为该晶体的一个晶胞(晶体中最小重复单元).下列有关说法正确的是( )| A、晶体中所有原子间都以离子键结合 |
| B、晶体中与每个K+距离最近且相等的O2-有6个,距离最近且相等的K+有12个 |
| C、该晶体的化学式为KO2,则每个晶胞中只有1个K+和1个O2- |
| D、该晶体中阴阳离子个数之比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com