
| A、A、B中SO2的转化率相同 |
| B、B中的反应速率比A中快 |
| C、A中SO2的转化率比B中高 |
| D、若A、B中皆再加入同量的氩气,平衡不移动 |


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
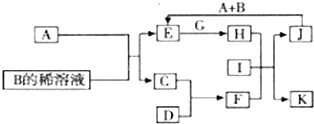 A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
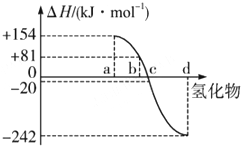 热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H),图为氧族元素氢化物a、b、c、d的生成热数据示意图,(氧族元素包括氧、硫、硒、碲).试完成下列问题:
热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H),图为氧族元素氢化物a、b、c、d的生成热数据示意图,(氧族元素包括氧、硫、硒、碲).试完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
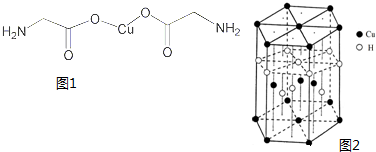 (1)亚铜离子(Cu+)基态时的价电子排布式表示为
(1)亚铜离子(Cu+)基态时的价电子排布式表示为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(1)(2)(3)(7) |
| B、(2)(3)(5)(7) |
| C、(2)(5)(6) |
| D、(2)(3)(4)(5)(7) |
查看答案和解析>>
科目:高中化学 来源: 题型:
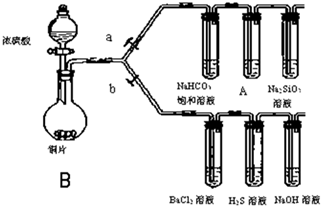 根据要求完成下列各小题实验目的.(如图a、b为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的.(如图a、b为弹簧夹,加热及固定装置已略去)| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com