
科目: 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关,下列说法正确的是( )
A.氢氧化铁胶体、淀粉溶液均具有丁达尔效应
B.“玉不琢不成器”“百炼方能成钢”发生的均为化学变化
C.汽车尾气中的氮氧化物是汽油或柴油不完全燃烧造成的
D.脂肪、蛋白质、纤维素和淀粉都属于高分子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
(1)六种元素中第一电离能最小的是(填元素符号,下同),电负性最大的是 .
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂).请写出黄血盐的化学式 , 1mol,AB﹣中含有π键的数目为 , 黄血盐晶体中各种微粒间的作用力不涉及(填序号).
a.离子键b.共价键 c.配位键d.金属键 e.氢键f.分子间的作用力
(3)E2+的价层电子排布图为 , 很多不饱和有机物在E催化下可与H2发生加成反应:如①乙烯、②乙炔、③苯、④甲醛.其中碳原子采取sp2杂化的分子有(填物质序号),HCHO分子的立体结构为形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 . 金属C的晶胞中,若设该晶胞的密度为ag/cm3 , 阿伏加得罗常数为NA , C原子的摩尔质量为M,则表示C原子半径的计算式为 . 
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下向10mL 0.1molL﹣1CH3COONa溶液中,不断通入HCl后,CH3COO﹣与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( ) 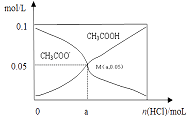
A.M点溶液中水的电离程度比原溶液小
B.在M点时,c(H+)﹣c(OH﹣)=(100a﹣5.0×10﹣2) mol/L
C.随着HCl的通入, ![]() 值不断减小
值不断减小
D.当n(HCl)=1.0×10﹣3mol时,溶液中c(Na+)>c(Cl﹣)>c(CHCOO﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
科目: 来源: 题型:
【题目】常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害,某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源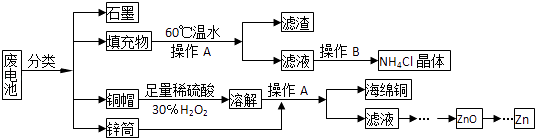
(1)填充物用60℃温水溶解,目的是 .
(2)操作A的名称为 .
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示).铜帽溶解完全后,可采用方法除去溶液中过量的H2O2 .
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+Zn(OH)2 , 其负极的电极反应式为 .
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止.主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4═3MnSO4+4CO2↑+6H2O.①当1molMnO2参加反应时,整个反应共有mol电子发生转移.
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酰氯(SO2Cl2)常用做氯化剂或氯磺化剂,如芳香族化合物的氯化、羧酸的氯化及其他各种有机和无机化合物的氯化,也用于制造药品、燃料、表面活性剂等.硫酰氯通常条件下为无色液体,熔点为﹣54.1℃,沸点为69.1℃,在潮湿空气中易“发烟”,100℃以上便开始分解为二氧化硫和氯气,工业上常采用氧化法合成硫酰氯,将干燥的二氧化硫和氯气在一定条件下进行反应,其反应原理和实验装置如下: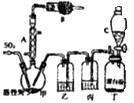
SO2(g)+Cl2(g) ![]() SO2Cl2(l)△H=﹣97.3kJmol﹣1 请回答下列问题:
SO2Cl2(l)△H=﹣97.3kJmol﹣1 请回答下列问题:
(1)仪器A的名称是
(2)干燥管B中盛放的药品是 , 作用是
(3)实验时从仪器C中放出液体的操作方法是
(4)装置乙中盛放的物质为 , 若缺少装置乙,对实验结果有什么影响?
(5)氯磺酸(ClSO3H)是一种无色的发烟液体,有刺激性臭味,沸点178℃,受热分解也能制得硫酰氯,同时还有另外一种物质生成,该反应的化学方程式为 , 分离产物的方法是
A.重结晶 B.过滤 C.蒸馏 D.萃取
(6)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有(填序号)
A.控制气流速度,宜慢不宜快
B.水浴加热三劲烧瓶
C.若三劲烧瓶发烫,可适当降温.
查看答案和解析>>
科目: 来源: 题型:
【题目】有一无色未知溶液中检验出有Ba2+、Ag+ , 同时又测得其酸性很强.某学生还要鉴定此溶液中是否大量存在①Cu2+ ②Fe3+ ③Cl﹣ ④NO ![]() ⑤S2﹣ ⑥CO
⑤S2﹣ ⑥CO ![]() ⑦NH
⑦NH ![]() ⑧Mg2+ ⑨Al3+ , 而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是( )
⑧Mg2+ ⑨Al3+ , 而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是( )
A.③⑤⑥⑦⑨
B.①②⑤⑥⑧
C.③④⑦⑧⑨
D.①②③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】锂空气电池比锂离子电池具有更高的能量密度,前景非常广阔,其结构及工作原理如图(固体电解液只允许Li+通过),下列有关说法不正确的是( ) 
A.电池工作时,正极反应式:O2+2H2O+4e﹣=4OH﹣
B.去掉固体电解液和有机电解质,电池反应发生改变
C.充电时,生成14 g Li,空气极质量增加16 g
D.充电时,专用充电电极可以有效防止空气极腐蚀和劣化
查看答案和解析>>
科目: 来源: 题型:
【题目】小明同学设计了如图所示装置探究铜跟浓硫酸的反应.先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余.接着再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢减少.请回答下列问题:
(1)请写出上述过程A装置中所涉及的任意一个化学反应方程式;
(2)张老师认为整个装置设计有一点错误,你认为(填“A”、“B”或“C”)部分有错误.
(3)B中所收集到的气体既具有氧化性又具有还原性,请写出一个体现其还原性的化学方程式 .
(4)装置C中所选用的溶液试剂一般是(填化学式).
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量 浓度(mol·L-1) | NaOH物质的量 浓度(mol·L-1) | 混合溶 液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请根据要求回答:
(1)②组情况表明,c________ (选填“大于”、“小于”或“等于”)0.2。混合液中离子浓度c(A-)与c(Na+)的大小关系是______________________________________。
(2)从③组实验结果分析,说明HA的电离程度________(选填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是_____________________________。
(3)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。写出该混合溶液中下列算式的结果(不能作近似计算)。c(Na+)-c(A-)=________mol·L-1; c(OH-)-c(HA)=________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳经济的概念在中国正迅速从高端概念演变成全社会的行为,在新能源汽车、工业节能等多个领域都大有作为.请运用化学反应原理的相关知识研究碳及其化合物的性质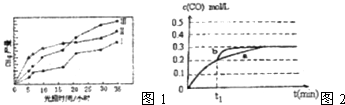
(1)实验室里常用NaOH溶液吸收CO2 , 若用100mL 3molL﹣1的NaOH溶液吸收4.48L(标准状况下)CO2 , 完全吸收反应后,所得溶液中离子浓度由大到小的顺序为
(2)工业上可利用CO或CO2来制备清洁液体燃料甲醇.已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0反应①:2H2(g)+CO(g)CH3OH(g)△H=﹣90.8kJmol﹣1
反应②:H2(g)+CO2(g)H2O(g)+CO(g)△H=+41.2kJmol﹣1
写出用CO2与H2反应制备甲醇的热化学方程式 , 800℃时该反应的化学平衡常数K的数值为
(3)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2 , 紫外线照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图1所示,在0﹣15h内,对反应催化效果最好的催化剂是(填序号)
(4)一定温度下,在3L容积可变的密闭容器中发生上述反应②,已知c(CO)随反应时间t的变化曲线a如图2所示,在t1时刻改变一个条件,曲线a变为b,则改变的条件是 , 若在t1时刻,将容器体积3L快速压缩至2L,在图上画出变化曲线
(5)钡及其化合物在工业上有着广泛的应用,在地壳中常以硫酸盐的形式存在,BaSO4是难溶性盐.工业上提取钡时首先用Na2CO3溶液将BaSO4转化成难溶弱酸盐(BaCO3).请写出将BaSO4转化成BaCO3的离子方程式该反应的平衡常数为(填具体数字),已知Ksp(BaSO4)=1.1×10﹣10mol2L﹣2 , Ksp(BaCO3)=2.5×10﹣9mol2L﹣2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com