
科目: 来源: 题型:
【题目】下列说法正确的有()个
①将铁屑放入稀HNO3中,证明Fe比H2活泼
②FeCl3腐蚀Cu 制印刷电路板是由于铁比铜的金属性强
③检验溶液中是否含有Fe2+,取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN 溶液,观察实验现象
④磁性氧化铁溶于稀硝酸的离子方程式为:3Fe2++4H++NO3-==3Fe3++NO↑+3H2O
⑤将NaOH浓溶液滴加到饱和的FeCl3溶液中,制备Fe(OH)3胶体
⑥氢氧化铁与HI溶液反应的离子方程式为: Fe(OH)3+3H+==Fe3++3H2O
⑦铁与水蒸气在高温下的反应产物为Fe2O3 和H2
⑧1mol FeI2与足量氯气反应时转移的电子数为3NA
⑨检验Fe (NO3)2晶体是否氧化变质的方法是将Fe (NO3) 2样品溶于稀H2SO4后,滴加KSCN 溶液,观察溶液是否变红
⑩图示装置能较长时间观察到Fe (OH) 2白色沉淀
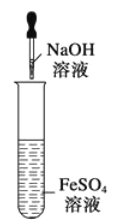
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )
A.78g苯中含有的碳碳双键的数目为3NA
B.16g由Cu2S和CuO组成的混合物中含有的阳离子数为0.2NA
C.将1molH2与1molI2充入一密闭容器中充分反应后,转移的电子数为2NA
D.1mo1Fe与足量的浓硫酸共热反应,生成SO2的分子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年8月10日《生物谷》载文称,“毒性气体”CO,NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( ) 
A.都是电解质
B.都易溶于水
C.都能与碱溶液反应
D.都属于共价化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】2015年,我国女药学家屠呦呦因发现了青蒿素( C15H22Os)而获得诺贝尔奖,青蒿素的一种化学合成路线如图: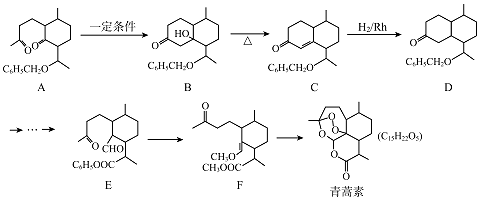
(1)化合物D的分子式为 , D中含有的官能团名称是 .
(2)合成A常用到原料 ![]() ,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法 , 写出X与银氨溶液发生的离子反应方程式 .
,现有相对分子质量最小的该原料的同系物X,检验X中碳碳双键的操作方法 , 写出X与银氨溶液发生的离子反应方程式 .
(3)B﹣C的反应类型为 .
(4)E﹣F的过程中常用HSCH2CH2CH2SH对E进行官能团保护,含﹣SH(巯基)叫硫醇,根据系统命名法,HSCH2CH2CH2SH的名称是
(5)同时满足以下条件的青蒿素的同分异构体共有种.
①常温下,能与NaHCO3溶液反应;②能与FeCl3溶液发生显色反应;③1mol该物质与足量的Na反应,产生2mol H2;④质谱与红外表明分子中含2个 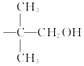 基团;
基团;
⑤苯环上只有一种化学环境的氢.
(6)参考上述合成路线,写出由苯甲醛和乙醇为原料,经三步制备3﹣苯基丙烯醛的合成路线(无机试剂任选). 合成路线示例是:CH2=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH.
CH3CH2OH.
查看答案和解析>>
科目: 来源: 题型:
【题目】将ag铁和氧化铁的混合物加入800mL0.1mol/L 的盐酸中充分反应后,盐酸全部消耗,放出标准状兄下气体0.224L。则下列判断中正确的是 ( )
A. 原混合物中n (Fe) :n (Fe2O3) =2: 1 B. 向溶液中滴入KSCN 溶液,显血红色
C. 无法计算出原混合物的质量 D. 此混合物中铁元素的质量分数为68.6%
查看答案和解析>>
科目: 来源: 题型:
【题目】通过溶解、过滤、蒸发等操作,可将下列各组固体物质分离的是()
A. 氯化钾 碳酸钙 B. 氧化铜 二氧化锰
C. 硝酸钠 氢氧化钠 D. 硫酸铜 氢氧化钙
查看答案和解析>>
科目: 来源: 题型:
【题目】已知铜的配合物A(结构如图1).请回答下列问题: 
(1)Cu的简化电子排布式为 .
(2)A所含三种元素C、N、O的第一电离能由大到小的顺序为 . 其中氮原子的杂化轨道类型为
(3)配体氨基乙酸根(H2NCH2COO﹣)受热分解可产生CO2和N2 , N2中σ键和π键数目之比是;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为 .
(4)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中HCO的键角(选填“大于”、“等于”或“小于”)120°;甲醛能与水形成氢键,请在图2中表示出来 .
(5)立方氮化硼(如图3)与金刚石结构相似,是超硬材料.立方氮化硼晶体内B﹣N键数与硼原子数之比为;结构化学上用原子坐标参数表示晶胞内部各原子的相对位置,如图4立方氮化硼的晶胞中,B原子的坐标参数分别有:B(0,0,0);B( ![]() ,0,
,0, ![]() );B(
);B( ![]() ,
, ![]() ,0)等.则距离上述三个B原子最近且等距的N原子的坐标参数为 .
,0)等.则距离上述三个B原子最近且等距的N原子的坐标参数为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:CO(g)+2H2(g)CH3OH(g)△H=akJ/mol
已知:①CO(g)+ ![]() O2(g)═CO2(g)△H1=﹣283.0kJ/mol
O2(g)═CO2(g)△H1=﹣283.0kJ/mol
②H2(g)+ ![]() O2(g)═H2O(g)△H2=﹣241.8kJ/mol
O2(g)═H2O(g)△H2=﹣241.8kJ/mol
③CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2O(g)△H3=﹣192.2kJ/mol
O2(g)═CO2(g)+2H2O(g)△H3=﹣192.2kJ/mol
答下列问题:
(1)a=
(2)能说明反应CO(g)+2H2(g)CH3OH(g)已达平衡状态的是(填字母).
A.单位时间内生成1mol CH3OH(g)的同时消耗了1mol CO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充人物质的量之
和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与 ![]() 的关系如图1所示.
的关系如图1所示.
①当起始 ![]() =2,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)= . 若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将(选填“增大”、“减小”或“不变”);
=2,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)= . 若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将(选填“增大”、“减小”或“不变”);
②当 ![]() =3.5时,达到平衡状态后,CH3 OH的体积分数可能是图像中的点(选填“D”、“E”或“F”)
=3.5时,达到平衡状态后,CH3 OH的体积分数可能是图像中的点(选填“D”、“E”或“F”)
(4)CO和H2来自于天然气.已知CO2(g)+CH4 (g)2CO(g)+2H2 (g).在密闭容器中有浓度均为0.1molL﹣1的CH4与CO2 , 在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图2,则压强p1p2(选填“大于”或“小于”);当压强为p2时,在y点:v(正)v(逆)(选填“大于”、“小于”或“等于”).若p2=3MPa,则T℃时该反应的平衡常数Kp=MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数). 
(5)含有甲醇的废水会造成环境污染,可通入ClO2气体将其氧化为CO2 . 写出相关反应的离子方程式
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物理量相应的单位表达错误的是( )
A. 摩尔质量g/molB. 气体摩尔体积L/mol
C. 阿伏伽德罗常数 mol / NAD. 密度g/cm3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com