
科目: 来源: 题型:
【题目】以NA代表阿伏加德罗常数,则关于热化学方程式 C2H2 (g) +5/2O2 (g) →2CO2 (g)+H2O(l) △H = —1300kJ / mol 的说法中,正确的是 ( )
A. 当8 NA个电子转移时,该反应放出1300kJ的能量
B. 当1 NA个水分子生成且为液体时,吸收1300kJ的能量
C. 当2 NA个碳氧共用电子对生成时,放出1300kJ的能量
D. 当8 NA个碳氧共用电子对生成时,放出1300kJ的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】氨、磷属于同一主族元素,是组成生命体的重要元素,其单质及化合物用途广泛。回答下列问题:
(1)基态P原子的核外电子排布式为_____,磷及其同周期相邻元素第一电离能由大到小的顺序是______________________。
(2)NH3比PH3易液化的原因是______________________。
(3)自然固氨现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①N2分子结构中。σ键和π键之比为_________,己知N![]() N的键能为946kJ·mol-1,远大于N—N的键能(193 kJ·mol-1)的三倍,原因是______________________。
N的键能为946kJ·mol-1,远大于N—N的键能(193 kJ·mol-1)的三倍,原因是______________________。
②NO3-中N原子采取___________杂化方式,其空间构型为__________,写出它的一种等电子体的化学式_____________________。
③已知酸性:HNO3>HNO2,下列相关见解合理的是_________________。
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
(4)磷化硬(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,图中a点和b点的原子坐标参数依次为(0,0,0)、(![]() ,
, ![]() ,
, ![]() ),则c 点的原子坐标参数为_______。已知该晶体密度为ρg·cm-3,则B-P键的键长为_____pm (阿伏加德罗常数用NA表示,列出计算式即可)。
),则c 点的原子坐标参数为_______。已知该晶体密度为ρg·cm-3,则B-P键的键长为_____pm (阿伏加德罗常数用NA表示,列出计算式即可)。

查看答案和解析>>
科目: 来源: 题型:
【题目】用质量分数为98%,密度为1.84 g·cm-3的浓硫酸配制200 mL 1.84 mol·L-1的稀硫酸,提供的仪器有:A.100 mL量筒,B.20 mL量筒,C.200 mL容量瓶,D.500 mL容量瓶,E.50 mL烧杯,F.胶头滴管,G.玻璃棒。
(1)配制该溶液,应取用浓硫酸的体积为________。
(2)实验操作过程中,应选用仪器的先后顺序是________________(填字母)。
(3)配制过程中若出现以下情况,对所配稀硫酸的浓度有什么影响?(填“偏大”“偏小”或“无影响”)
①用量筒量取浓硫酸时,俯视量筒刻度线:________。
②用于引流的玻璃棒没有洗涤:________________。
③定容时,仰视观察容量瓶刻度线:________________。
④定容后摇匀,发现液面低于刻度线,又滴加水至液面与刻度线刚好相平:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由芳香族化合物A为原料合成液晶材料(H)的一种合成路线如下:
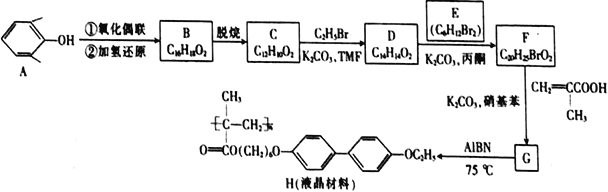
已知:B和C互为同系物,均能与FeCl3溶液发生显色反应且分子中均有3种不同化学环境的氢原子。
回答下列问题:
(1)G中所含官能团的名称是______________。C生成D的反应类型为__________。
(2)D的核磁共振氢谱有________个峰。
(3)B的结构简式为___________________。
(4)D和E生成F的化学方程式为__________________________。
(5)A的同分异构体中属于芳香族化合物但不能与FeCl3溶液发生显色反应的有__________种。
(6)写出以对甲苯酚和乙醇为原料制备H5C2O![]() COOC2H5(对乙氧苯甲酸乙酯)的合成路线______(其他无机试剂任选)。
COOC2H5(对乙氧苯甲酸乙酯)的合成路线______(其他无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列递变规律不正确的是
A.Na、Mg、Al原子的失电子能力逐渐减弱
B.Si、P、S元素的最高正化合价依次降低
C.C、N、O的原子半径依次减小
D.Cl、Br、I的气态氢化物的稳定性依次减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】对下列物质分类全部正确的是( )
①纯碱 ②食盐水 ③石灰水 ④NaOH ⑤液态氧 ⑥KClO3 .
A.碱①④
B.纯净物③④⑤
C.盐①⑥
D.混和物②⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A.Na+、Mg2+、Cl﹣、SO42﹣
B.Cu2+、Cl﹣、NO3﹣、OH﹣
C.Ca2+、Na+、CO32﹣、NO3﹣
D.K+、Fe3+、NO3﹣、SCN﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】叠氮化钠常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及步骤如下:

已知:①NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
②NaNH2的熔点为210℃,沸点为400℃,在水溶液中易水解。
实验步骤:
①打开装置A导管上的旋塞,加热制取氨气;
②再加热装置D中的金属钠,使其熔化并充分反应后,再停止加热A并关闭旋塞;
③向装置D中b容器内充入加热介质并加热到210~220℃,然后按图通入N2O;
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩、结晶;
⑤过滤,用乙醚洗涤,晾干。
回答下列问题:
(1)装置C中盛放的药品为______;装置B的主要作用是_____________。
(2)步骤①先加热通氨气的目的是__________________;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为__________________。
(3)步骤③b容器充入的介质为植物油,进行油浴而不用水浴的主要原因是_________。
(4)生成NaN3的化学方程式为________________。
(5)图中仪器a用不锈钢材质的而不用玻璃的,其主要原因是_________。
(6)步骤⑤用乙醚洗涤的主要目的是_____________________。
(7)消防时,常用1mol·L-1的NaClO溶液将NaN3转化为N2,则销毁650g NaN3至少需要_____LNaClO溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质用途的说法中错误的是( )
A.氯气可用于自来水的消毒
B.四氧化三铁常用作红色油漆和涂料
C.明矾可用于净水
D.过氧化钠用于呼吸面具和潜水艇里氧气的来源
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
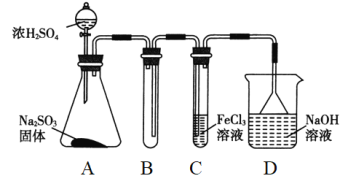
(1)通入足量SO2时C中观察到的现象是______________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:_______________________;
②请设计实验方案检验有Fe2+生成:_________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法_____(填“合理”或“不合理”),理由是______。
(3)D装置中倒置漏斗的作用是__________________________。
(4)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com