
科目: 来源: 题型:
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应。
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色。
探究1:白色沉淀产生的原因。
(1)白色沉淀是_________(填化学式)。
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2。
①支持甲同学观点的实验证据是______________。
②乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mL___mol/L ___溶液(填化学式)中通入SO2 | ____________ |
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起到了主要作用。
实验操作 | 实验数据 |
向烧杯中加入煮沸了的0.1 mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 |
图1:向BaCl2 (无氧)溶液中通入SO2 |
向烧杯中分别加入25mL 0.1 mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线。 |
图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(3)图1,在无氧条件下,向BaCl2溶液中持续通入SO2,溶液pH下降是因为_________(用方程式表示)。
(4)图2,BaCl2溶液中发生反应的离子方程式为___________。
(5)依据上述图像你得出的结论是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是高铁电池的重要原料,也是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
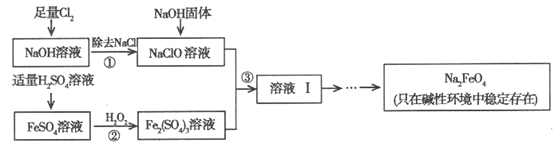
回答下列问题:
(1)Cl2与NaOH溶液反应的离子方程式是__________________。
(2)经过步骤①后,加入NaOH固体的原因是________________________。
(3)步骤②反应的离子方程式是_______________。
(4)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为_______________。
(5)Na2FeO4投入到污水中杀菌消毒,生成的Fe(OH)3可以起到絮凝剂的作用。通过计算得知Na2FeO4的消毒效率(以单位质量的消毒剂得到的电子数表示)比氯气的_________(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是_________(答出一点即可)。
(6)高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH放电时,负极的电极反应式是_____。正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。
3Zn(OH)2+2Fe(OH)3+4KOH放电时,负极的电极反应式是_____。正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
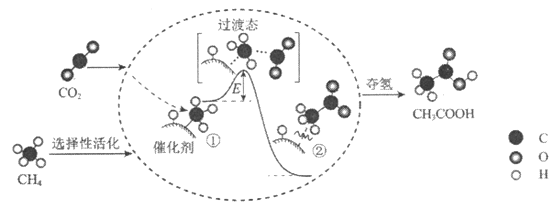
下列说法不正确的是
A. 该反应是化合反应
B. 催化剂参加了化学反应过程
C. CH4→CH3COOH过程中,有C—H键的断裂和形成
D. ①→②过程中,形成了C—C键,断裂的化学键的总键能<形成的化学键的总键能
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
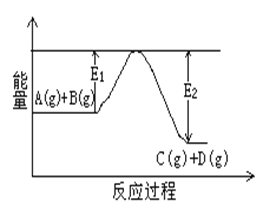
(1)反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图 所示,判断该反应△H___________0 (填“>”、“<”、“无法确定”)。
C(g)+D(g)过程中的能量变化如图 所示,判断该反应△H___________0 (填“>”、“<”、“无法确定”)。
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)= CO (g)+ H2O (g) △H1= + 34.0 kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2= —7.0 kJ/mol
则甲酸的分子式为____________,在该条件下,气态CO2 和气态H2 生成气态CO和气态H2O的热化学方程式为 __________________________________________________________________。
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2)。当把0.4mol液态肼和0.8mol 液态H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。反应的热化学方程式为:____________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+>I2。)下列说法正确的是
A. 铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI![]() CeI4+ 2H2↑
CeI4+ 2H2↑
B. 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4+ + 2Fe2+=Ce3++ 2Fe3+
C. 在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
D. 铈的四种核素![]() 、
、![]() 、
、![]() 、
、![]() ,它们互称为同素异形体
,它们互称为同素异形体
查看答案和解析>>
科目: 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 丙烷和丁烷互称为同系物
B. ![]() 的名称为3-甲基丁烷
的名称为3-甲基丁烷
C. 沸点:正丁烷>异丁烷>丙烷
D. CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:转化率=某一反应物转化的量÷该反应物的初始量×100%。在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论不正确的是
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
A. 在t4时刻,该反应处于化学平衡状态
B. t3时,A的转化率比B的转化率高
C. t1至t2时刻,该反应的速率为3 mol·L-1 s-1
D. 该反应的化学方程式是:2A(g)+B(g)![]() C(g)
C(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是
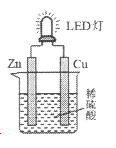
A. 溶液中的SO42-向铜极移动
B. 锌片为原电池的负极,发生还原反应
C. 如果将稀硫酸换成柠檬汁,导线中不会有电子流动
D. 铜片表面有气泡生成,发生的反应为:2H++2e-=H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下体积不变的密闭容器中,可逆反应A(g)+3B(g)![]() 2C(g)+2D(g)达到平衡状态的标志是
2C(g)+2D(g)达到平衡状态的标志是
A. 各物质的浓度相等
B. A、B、C、D的浓度之比为1:3:2:2
C. 正反应速率与逆反应速率均为零
D. 正反应速率与逆反应速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com