
科目: 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΔH=-226kJ/mol
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】原子中质子、中子、电子的数量、质量和电性之间存在一定的相互关系。请填写下列空白:
(1)质子数决定________的种类;质子数和中子数决定________的种类。
(2)![]() 代表一个质量数为________、质子数为______、中子数为________、核外电子数为________的原子。
代表一个质量数为________、质子数为______、中子数为________、核外电子数为________的原子。
(3)质量数=________+________,对任一原子,核电荷数=________;对中性原子,核外电子数=________。
(4)ZXn-中核外电子数=________,ZXn+中核外电子数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中 T 所处的周期序数与族序数相等。下列判断不正确的是
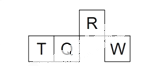
A. 最简单气态氢化物的热稳定性:R > Q
B. 最高价氧化物对应水化物的酸性:Q < W
C. 原子半径:T > Q > R
D. 含 T 的盐溶液一定显酸性
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,所含分子数相同的是
A. 10g H2和10g O2
B. 5.6L N2(标准状况)和11g CO2
C. 18g H2O和0.5mol Br2
D. 224 mL H2(标准状况)和0.1mol N2
查看答案和解析>>
科目: 来源: 题型:
【题目】有关2L 0.1 mol/L K2SO4溶液的叙述正确的是
A. 含有0.1 mol K2SO4 B. 水的体积为2L
C. K+的物质的量浓度为0.2 mol/L D. 取出1L溶液后,浓度变为0.05 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)![]() Si3N4(s)+ 6CO(g)
Si3N4(s)+ 6CO(g)
(1)该反应的氧化剂是________________,其还原产物是________________;
(2)该反应的平衡常数表达式为K=___________________________________;
(3)若知上述反应为放热反应,则其反应热△H_______0(填“>”、“<”或“=”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)= _____________________.
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。图中t4时引起平衡移动的条件可能是______________;图中表示平衡混合物中CO的含量最高的一段时间是____________。

(5)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是_________________(提示:272 =729)。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业合成氨的反应为:N2+3H2![]() 2NH3,该反应在一定条件下的密闭容器中进行。下列关于该反应的说法正确的是( )
2NH3,该反应在一定条件下的密闭容器中进行。下列关于该反应的说法正确的是( )
A. 达到平衡时,反应速率:v(正)=v(逆)=0
B. 使用催化剂可加快反应速率,提高生产效率
C. 为了提高H2的转化率,应适当增大H2的浓度
D. 若在密闭容器加入1molN2和过量的H2,最后能生成2molNH3
查看答案和解析>>
科目: 来源: 题型:
【题目】 [物质结构与性质]
臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为![]() 和
和![]() ,NOx也可在其他条件下被还原为N2。
,NOx也可在其他条件下被还原为N2。
(1)![]() 中心原子轨道的杂化类型为___________;
中心原子轨道的杂化类型为___________;![]() 的空间构型为_____________(用文字描述)。
的空间构型为_____________(用文字描述)。
(2)Fe2+基态核外电子排布式为__________________。
(3)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com