
科目: 来源: 题型:
【题目】下列分析中正确的是( )
A. 含有碳元素的化合物不一定是烃
B. 正丁烷分子中四个碳原子可能在同一直线上
C. 常温常压下 是气态
是气态
D. 烷烃在任何情况下均不与强酸、强碱、氧化剂反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭的2L容器中装有2 mol N2和6mol H2,在一定条件下开始反应。2 min末测得容器中有1.2mol N2,试计算:
(1)2min末N2的浓度;__________
(2)2min内NH3的平均反应速率;__________
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定某草酸(H2C2O4)溶液的浓度,进行如下实验:
取25.00mL某草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为0.10molL-1的KMnO4溶液滴定到终点,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O试回答:
(1)实验中,标准液KMnO4溶液应装在________式滴定管中,因为_____________;
(2)实验中眼睛注视_________________,直至滴定终点;判断到达终点的现象是___________________________________________ ;
(3)若实验所用KMnO4溶液体积为21.00mL,则草酸溶液的浓度为_______________;
(4)实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)
A.滴定前仰视刻度,滴定后俯视刻度________________________;
B.锥形瓶在盛放待测液前未干燥,有少量蒸馏水______________________________;
C.滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题
学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理请回答下列问题:
(1)常温下,某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈 ______性,原因是________________;用离子方程式表示
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于 ______________;
(3)已知在H2S溶液中存在下列平衡: H2S![]() H++HS-
H++HS-
向H2S溶液中加入NaOH固体时,不考虑温度变化电离平衡向______移动,填“左”或“右”),c(H+)______。(填“增大”、“减小”或“不变”
向H2S溶液中加入NaHS固体时,电离平衡向______移动,填“左”或“右”)c(S2—)______。(填“增大”、“减小”或“不变”)

(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ______ 填“A”或“B”;设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1______ m2。 (选填“![]() ”、“
”、“![]() ”、“
”、“![]() ”
”
查看答案和解析>>
科目: 来源: 题型:
【题目】氢叠氨酸(HN3)及其盐(NaN3、NH4N3、CuN3等) 都具有爆炸性,最近南京理工大学胡丙成教授团队成功合成出PHAC,其化学式为(N3)3 (NH4)4Cl。回答问题:
(1) PHAC中“N3”的化合价为_____________,N2F2的电子式为_____________。
(2)汽车安全气囊中NaN3可发生下列反应:
NaN3(s)=Na(s)+![]() N2(g) △H1
N2(g) △H1
2NaN3(s)+CuO(s)=Na2O(s)+3N2(g)+Cu(s) △H2
则反应CuO(s)+2Na(s)= Na2O(s)+ Cu(s) △H=_______(用△H1和△H2表示)
(3) 25℃,将1molNH4N3(s)投入一2L的恒容密闭容器中,0.5min后反应达到平衡,测得生成的两种单质的物质的量之和为1.6mol,则NH4N3的平衡转化率为________,25℃时该反应的平衡常数K=__________。
(4) 氢叠氨酸(HN3)易溶于水,且酸性与醋酸相近。
① HN3在水溶液中的电离方程式为_____________。
② 0.1mol·L-1的HN3溶液与0.1mol·L-1的NaN3等体积混合,混合溶液中各离子浓度有大到小的顺序为_________________。
③ 已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下反应:
Cu2S(s)+2N3-(aq) ![]() 2CuN3(s)+S2-(aq)的平衡常数K=_______________。
2CuN3(s)+S2-(aq)的平衡常数K=_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列七种物质的溶液:
①NaCl ②NH4Cl ③Na2CO3 ④CH3COONa ⑤CH3COOH ⑥NaHCO3
(1)溶液呈酸性的有_____________,呈碱性的有____________,呈中性的有_____________。
(2)写出②④水解的离子方程式:________________________、______________________
(3)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类_____________(填相同或是不相同),溶液的PH:③_________⑥(填 >、=或 <)。
(4)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变大的是______________。
A.c(H+) B. C.c(H+)·c(OH-)
C.c(H+)·c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O72-+H2O![]() 2HCrO4
2HCrO4![]() 2CrO42-+2H+
2CrO42-+2H+
(1)重铬酸钾溶液呈______性,在强碱溶液中,铬元素的主要存在形式为________(填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O72-)/c(CrO42-)将______(填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)若溶液中只溶解了一种溶质,则该溶质是 ________,上述四种离子浓度的大小顺序为________(选填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为________;
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3·H2O) (填“大于”“小于”或“等于”)。
III.重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,d≈1 g·mL-1)中含有Ag+,Pb 2+等重金属离子,其浓度各约为0.0lmol·L-1。排放前拟用沉淀法除去这两种
离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入________________(填字母序号),沉淀效果最好。
A. NaOH B.Na2S C.KI D. Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)常温下,将0.2 mol·L-1的某一元酸HA溶液和0.1 mol·L-1NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是________。
A.c(HA)<c(A-) B.c(HA)一定大于0.1 mol·L-1
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)在t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=___________mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
(3)常温下在20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。

回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度之间的等量关系是__________________。
③已知在25 ℃时,CO32-水解反应的平衡常数Kh=c(HCO3-).c(OH-)/c(HCO3-)=2×10-4,当溶液中c(HCO3-)∶c-(CO32-)=2∶1时,溶液的pH=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语正确的是( )
A. H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
B. NaHSO4在水溶液中的电离方程式: NaHSO4= Na++H++SO42-
C. Na2CO3的水解∶CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. NH4Cl的水解:NH4++H2O = NH3·H2O+H+
查看答案和解析>>
科目: 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如图一
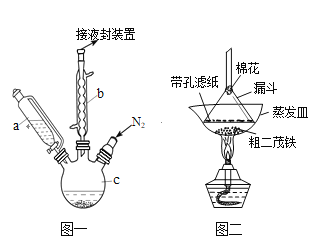
已知:①二茂铁熔点是173℃,在100℃时开始升华;沸点是249℃。
②制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6= Fe(C5H5)2+2KCl+2H2O
实验步骤为:
①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(C5H6, 密度为0.95g/cm3),搅拌;
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25mL装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min;
④再从仪器a加入25mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b的名称是________________________.
(2)步骤①中通入氮气的目的是____________________________________________________.
(3)仪器c的适宜容积应为(选编号):_________
①100mL ②250mL ③500mL
(4)步骤⑤用盐酸洗涤的目的是__________________________________________________
(5)步骤⑦是二茂铁粗产品的提纯,该过程在图二中进行,其操作名称为_________;该操作中棉花的作用是______________________________________________________.
(6)为了确认得到的是二茂铁,还需要进行的一项简单实验是__________________________;若最终制得纯净的二茂铁4.3g,则该实验的产率为____________(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com