
科目: 来源: 题型:
【题目】某研究性学习小组的甲、乙同学分别设计了以下实验来验证元素周期律。
(Ⅰ)甲同学在 a、b、c 三只烧杯里分别加入 50 mL 水,再分别滴加几滴酚酞溶液,依次加入 大小相近的锂、钠、钾块,观察现象。
①甲同学设计实验的目的是______
②反应最剧烈的烧杯是______(填字母);
③写出 b 烧杯里发生反应的离子方程式______
(Ⅱ)乙同学设计了下图装置来探究碳、硅元素的非金属性强弱,根据要求完成下列各小题
(1)实验装置:

(2)实验步骤: 连接仪器、______、加药品后,打开 a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是______,装置 E 中足量酸性 KMnO4 溶液 的作用是______。
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是______;
③试管 D 中发生反应的离子方程式是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入2L的恒容密闭容器中,在一定条件下发生反应PCl3(g)+Cl2(g)![]() PCl5(g),△H<0并于10 min时达到平衡。有关数据如下:
PCl5(g),△H<0并于10 min时达到平衡。有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度/(mol·L-1) | 2.0 | 1.0 | 0 |
平衡浓度/(mol·L-1) | c1 | c2 | 0.4 |
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/( L·min)
B. 升高温度,反应的平衡常数增大
C. 反应达到平衡时容器内的压强与初始时容器的压强之比为13:15
D. 平衡后移走2.0 mol PCl3和1.0 mol Cl2,相同条件下再达平衡时,c(PCl5)<0.2 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:Ag++ SCN- = AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。

下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ = 3AgSCN↓+ Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅥⅠA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为______。
(2)表中能形成两性氢氧化物的元素是______(用元素符号表示),写出该元素与⑨最高价氧化物的水化物反应的化方程式______。
(3)用电子式表示④元素与⑦元素形成化合物的过程______。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是______(填化 学式)。
(5)②的气态氢化物与最高价氧化物对应的水化物反应的离子方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有 A、B、C、D、E 五种短周期元素,已知 A、B、C、D 四种元素的核内质子数 之和为 56,在元素周期表中的位置如图所示,1 mol E 的单质可与足量酸反应,能产生 33.6 L H2(在标准状况下);E 的阳离子与 A 的阴离子核外电子层结构相同。回答下列问题:

(1)写出下列元素名称 A_______,B_______, E_______
(2)C 的简单离子结构示意图为_______
(3)A 与 E 形成的化合物的化学式为_______,它的性质决定了它在物质的分类中应属于_______
(4)D 和 E 形成化合物在熔融状态下不导电,原因是______。
(5)向 D 与 E 形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是______,写出有关化学反应方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】将4molSO2和2mol O2在2L的恒容密闭容器中混合,并在一定条件下发生如下反应: 2SO2(g)+ O2(g)![]() 2SO3(g),若经2s后测得SO3的浓度为0.6mol/L。下列说法中不正确的是
2SO3(g),若经2s后测得SO3的浓度为0.6mol/L。下列说法中不正确的是
A. 用SO2表示反应的平均速率为0.3mol/( L·s)
B. 用O2表示反应的平均速率为0.15mol/(L.s)
C. 2s时O2的浓度为0.7mol/L
D. 2s时SO2的转化率为70%
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列短周期元素的数据(已知 Be 的原子半径为 0.089nm):

(1)⑧号元素的在周期表中的位置是_______;上述元素处于同一主族的有_______。(用元素符号表示)
(2)上表中某两种元素形成的共价化合物中,每个原子都满足最外层为 8 电子的稳定结构,写 出其电子式:_______(任写一种)。
(3)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式_______。
(4)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH 等)、便携式电源材料(LiCoO2 等)。根 据下列要求回答问题:
![]() 和
和![]() 作核反应堆最佳热载体,
作核反应堆最佳热载体,![]() 和
和![]() 用作高温堆减速剂。下列说法正确的是_______
用作高温堆减速剂。下列说法正确的是_______
A.![]() 和
和![]() 互为同位素 B.
互为同位素 B.![]() 和
和![]() 属于同种核素
属于同种核素
C.![]() 和
和![]() 的化学性质不同 D.
的化学性质不同 D.![]() 和
和![]() 是同种物质
是同种物质
查看答案和解析>>
科目: 来源: 题型:
【题目】以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
I. N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(1) 碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是__________。
A.N2O分解反应中:k值与是否含碘蒸气有关 B.第三步对总反应速率起决定作用
C.第二步活化能比第三步小 D.IO为反应的催化剂
Ⅱ.汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体。如,
反应I:2CO +2NO N2+2CO2 △H1;反应II:4CO +2NO2 N2+4CO2 △H2<0。
(2) 针对反应I:
①已知:反应N2(g)+O2(g)2NO(g) △H3=+180.0kJ·mol1,若CO的燃烧热为-283.5kJ·moll 则反应I的△H1=_________kJ·mol1。
②若在恒容的密闭容器中,充入2molCO和1molNO,发生反应I,下列选项中不能说明该反应已经达到平衡状态的是_______。
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.2v(N2)正=v(CO)逆
(3) 在2L密闭容器中充入2 mol CO和1 molNO2,发生上述反应II。
①若在某温度下,该反应达平衡时CO的转化率为40%,则该反应的平衡常数为________。
图 1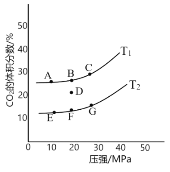 图 2
图 2 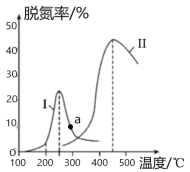
②图1为平衡时CO2的体积分数与温度、压强的关系。则温度:T1____T2(填“<”或“>”);若 在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(4) 某研究小组探究催化剂对CO、NO2转化的影响。将NO2和CO以一定的流速通过两种不同的 催化剂进行反应,相同时间内测量逸出气体中NO2含量,从而确定尾气脱氮率(脱氮率即NO2的转化率),结果如图2所示。若高于450℃,图2中曲线中脱氮率随温度升高而降低的主要 原因是___________________________;a点 ______________(填“是”或“不是”)对应温度下的平衡脱氮率,说明理由____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三硫化四磷用于制造火柴即火柴盒摩擦面,分子结构如图所示。下列有关三硫化四磷的说法正确的是( )
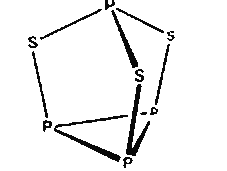
A. 该物质中磷元素的化合价为+3
B. 22 g P4S3含硫原子数目约为1.806×1023
C. 该物质分子结构中S、P最外层电子数均不为8
D. 该物质分子中全是极性共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法不正确的是( )

A.温度为78 ℃时固体物质M的化学式为FeSO4·4H2O
B.取适量380 ℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
D.温度为159 ℃时固体N的化学式为FeSO4·2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com