
科目: 来源: 题型:
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。 PPG的一种合成路线如下:
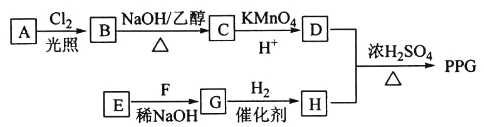
已知:①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④ 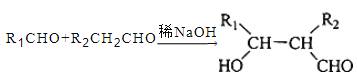 。
。
回答下列问题:
(1)A的结构简式为______________。
(2)由B生成C的化学方程式为________________________________________。
(3)由E和F生成G的反应类型为__________,G的化学名称为_____________。
(4)由D和H生成PPG的化学方程式为 ___________________________________。
(5)D的同分异构体中能同时满足下列条件的共有____种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体 ②既能发生银镜反应,又能发生皂化反应,其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是_________写结构简式):D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是___________(填标号)。a.质谱仪 b.红外光谱仪c.元素分析仪d.核磁共振仪
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方程式不正确的是
A.工业制造漂白粉的化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
B.制备硝基苯的化学方程式:![]() +HO-NO2
+HO-NO2
![]() +H2O
+H2O
C.将少量碳酸氢铵溶液滴入NaOH溶液反应的离子方程式:NH4++HCO3-+2OH-=NH3↑+CO32+2H2O
D.CuCl2的水解方程式:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇来源丰富,有广泛的用途和广阔的应用前景,工业上可以利用CO和CO2生产甲醇,同时可以利用甲醇生产丙烯。制备甲醇,丙烯过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.0kJ/mol
CH3OH(g) △H3=-90.0kJ/mol
反应Ⅳ:3CH3OH(g)![]() C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
C3H6(g)+3H2O(g) △H4=-31.0kJ/mol
回答下列问题:
(1)反应Ⅱ的ΔH2=________。
(2)反应Ⅲ能够自发进行的条件是________(填“较低温度”“较高温度”或“任何温度”),据研究该反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于保持催化剂Cu2O的量不变,原因是________(用化学方程式表示)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2的生成速率与CH3OH的生成速率相等
D.容器的压强不再变化
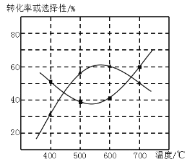
(4)甲醇生产丙烯的同时,还生成乙烯。在某催化剂作用下,2L密闭容器中加入0.5mol甲醇,经过相同时间后测得甲醇转化率及丙烯的选择性(生成丙烯的甲醇与甲醇转化量的比值)与反应温度之间的关系如图所示。计算600℃时反应甲醇生产丙烯的反应Ⅳ平衡常数________。若将容器体积压缩为1L,其他条件不变,在如图中作出甲醇平衡转化率随温度的变化曲线。________。
(5)研究表明,甲醇可由CO2在强酸性水溶液中通过电解合成,则生成甲醇的反应电极反应式:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】元素铬(Cr)的几种化合物存在下列转化关系,下列判断不正确的是
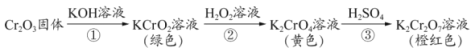
A.反应①表明Cr2O3有酸性氧化物的性质
B.反应②利用了H2O2的氧化性
C.反应②的离子方程式为2CrO2ˉ+3H2O2+2OHˉ=2CrO42ˉ+4H2O
D.反应①②③中铬元素的化合价均发生了变化
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,pH=1的某溶液中还含有 Na+、Fe3+、Fe2+、I-、Cl-、CO32-中的若干种,现取100mL 该溶液进行实验(不考虑实验操作过程中物质质量的损失,忽略溶液体积变化):①向该溶液中通入过量氯气,充分反应后加入CCl4进行萃取分液,得到水层和紫色有机层;②向实验①得到的水层,加入足量的NaOH溶液,产生沉淀,过滤,得到的沉淀进行洗涤、灼烧后得到1.60g固体;③向实验②所得滤液中加入硝酸银溶液和稀硝酸,产生白色沉淀;④向实验①所得到的紫色有机层,进行一系列操作后,得到2.54g紫黑色固体。根据实验结果,下列判断正确的是
A.不能确定Na+和Cl-是否存在,CO32-一定不存在
B.Fe2+、I-、Cl-三种离子一定存在
C.Fe3+、Fe2+至少有一种
D.该溶液中c(Cl-)≥0.1mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】锌—空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时,下列说法正确的是
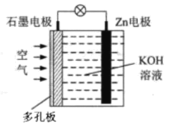
A.Zn电极是该电池的正极
B.Zn电极的电极反应:Zn+H2O-2e=ZnO+2H+
C.OH向石墨电极移动
D.标准状况下,当消耗11.2LO2时,电路中流过2mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】已知断裂1molH2(g)中的H-H键需要吸收436kJ能量,断裂1molI2(g)中的I-I键需要吸收151kJ能量,生成HI(g)中的1molH-I键能放出299kJ能量。下列说法正确的是
A.1molH2(g)和1molI2(g)的总能量为587kJ
B.H2(g)+I2(s)![]() 2HI(g)ΔH=-11kJ·molˉ1
2HI(g)ΔH=-11kJ·molˉ1
C.HI(g)![]()
![]() H2(g)+
H2(g)+![]() I2(g)ΔH=+5.5kJ·molˉ1
I2(g)ΔH=+5.5kJ·molˉ1
D.H-H键比I-I键更容易断裂
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:


实验步骤: 在A中加入4.4 g异戊醇(![]() ),6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
),6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)仪器B的名称是_________________。
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是________ (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)在洗涤操作中,第一次水洗的主要目的是________,第二次水洗的主要目的是___________。
(4)分液漏斗在使用前须清洗干净并_______,在洗涤、分液操作中,应充分振荡,然后静置,待分层后_________________(填标号),
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(5)本实验中加入过量乙酸的目的是_________________。
(6)实验中加入少量无水MgSO4的目的是_____________。
(7)在蒸馏操作中,仪器选择及安装都正确的是_____________ (填标号) 。

(8)本实验的产率是_____________
a. 30% b. 40% c. 50% d. 60%
(9)在进行蒸馏操作时,若从130 ℃开始收集馏分,会使实验的产率偏_____________ (填“高”或“低”),其原因是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,100mL0.1mol·L-1 的H2A 溶液中滴加0.1mol·L-1NaOH溶液,含A元素相关微粒物质的量随pH的变化如图所示。下列说法正确的是
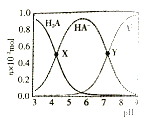
A.将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.X 点溶液中含A元素的相关离子存在以下关系:c(H2A)+c(HA-)+c(A2-)=0.1mol·L-1
D.Y点溶液中存在以下关系:c(H+) +c(Na+)=c(OH-)+3c(HA-)
查看答案和解析>>
科目: 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。
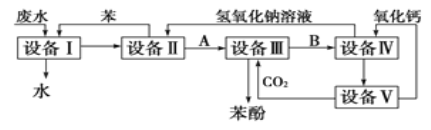
(1)流程图设备Ⅰ中进行的是________操作(填写操作名称)。
(2)由设备Ⅱ进入设备Ⅲ的物质A是________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是________。
(3)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和________。通过________(填操作名称)操作,可以使产物相互分离。
(4)图中,能循环使用的物质是________、________、NaOH和CaO(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com