
科目: 来源: 题型:
【题目】下列对一些实验事实的理论解释正确的是( )
选项 | 实验事实 | 理论解释 |
A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
B | SO2为V形分子 | SO2分子中S原子采用sp3杂化 |
C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
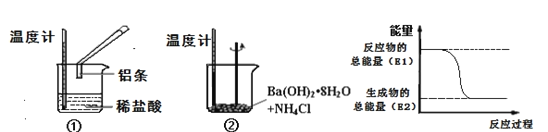
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。
(1)实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是__热反应,Ba(OH)28H2O与NH4Cl反应时,需要将固体研细其目的是__,反应过程__(填“①”或“②”)的能量变化可用图表示。
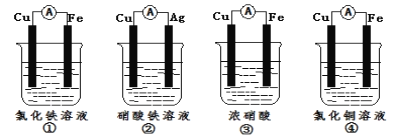
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是__(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述正确的是( )
A. 在![]() 分子中含有1个手性C原子
分子中含有1个手性C原子
B. 氢键是一种特殊化学键,它广泛地存在于自然界中
C. 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子
D. 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
查看答案和解析>>
科目: 来源: 题型:
【题目】第4周期的A、B、C、D四种元素,其最外层电子数依次为1、2、2、7。其原子序数按A、B、C、D顺序增大,已知A和B的次外层电子数均为8,而C与D的次外层电子数均为18,根据结构用元素符号或化学式填空:
(1)写出元素名称:A____、B_____、C _____、D ____。
(2)D的简单离子的电子排布式_______________。
(3)元素的氢氧化物碱性最强的是______________。
(4)B原子与D原子间形成化合物的电子式为____________。
(5)写出A、B的第一电离能大小____________________。
(6)写出C基态原子的外围电子排布图______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
第四周期 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的是:__(填元素符号),
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子__,碱性最强的化合物的电子式是:__。
(3)用电子式表示元素④与⑥的化合物的形成过程:__。
(4)表示①与⑦的化合物的电子式__,该化合物是由__(填“极性”或“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_(用化学式表示)。
(6)元素③的简单氢化物的结构式__,在常温下和元素⑦的单质反应的离子方程式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与工农业生产和日常生活密切相关,下列说法正确的是
A.漂白粉、漂白液和漂粉精既可作漂白剂,又可作消毒剂
B.硅胶可用作催化剂的载体,但不可用作干燥剂
C.常温下铝制容器可以盛放浓硫酸,是因为铝与浓硫酸不反应
D.明矾可作净水剂,是因为其溶于水电离出的Al3+具有强吸附性
查看答案和解析>>
科目: 来源: 题型:
【题目】资料显示:浅绿色的FeSO4·7H2O加热失水为FeSO4·H2O时呈白色,成FeSO4时为无色固体。FeSO4经加热可分解为FeO和SO3,经强热可分解为Fe2O3、SO3和SO2。SO3的熔点为16.8℃,沸点为44.8℃。化学兴趣小组对上述资料进行实验探究。
第一步:用绿矾制无水硫酸亚铁。
(1)把药品装在仪器(写名称)____中进行加热,已将结晶水除净的依据是(选填序号)___。
A.观察无水蒸汽产生 B.经恒重操作最后两次称量所得到的质量完全相同
C.晶体完全变为无色 D.经恒重操作最后两次质量差不超过天平感量误差
第二步:取一定量无水硫酸亚铁置于如图(部分夹持仪器略去)所示A的试管中进行加热。
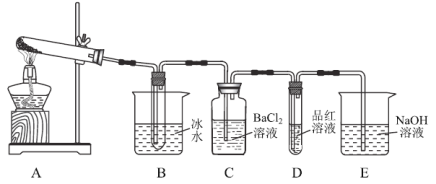
(2)实验过程中C、D、E中除有少许气泡外无其它明显现象。若将B试管中产生的少量固体溶于水,检验该溶液中的阴离子的方法是:___。实验过程中还有一处明显的现象是:________________。
第三步:将第二步实验的装置中A、B部分改为如图所示的![]() 、
、![]() ,C,D,E不变(C,E中都装有足量溶液)。
,C,D,E不变(C,E中都装有足量溶液)。
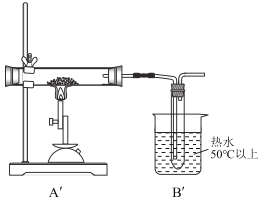
同样取一定量无水硫酸亚铁置于![]() 的石英玻璃管中进行加热,反应完毕后,从石英玻璃仪器中滞留气体排尽。观察到C中产生白色沉淀,D试管中溶液褪色。
的石英玻璃管中进行加热,反应完毕后,从石英玻璃仪器中滞留气体排尽。观察到C中产生白色沉淀,D试管中溶液褪色。
(3)实验中![]() 的玻璃管中的现象是:______,说出
的玻璃管中的现象是:______,说出![]() 装置的一个作用是:________。
装置的一个作用是:________。
最后将C中液体完全取出进行过滤、洗涤、干燥。称得所得固体质量为23.300g,所得溶液加水稀释定容为1L,取出20.00mL置于锥形瓶中,用已知浓度的标准NaOH溶液测定该1L溶液中一种溶质的浓度。
(4)上述实验过程中用到的定量仪器有_______,用到的指示剂是_______。
(5)将所得溶液加水定容时,加水所用的仪器名称为_____,若去称量![]() 玻璃管中残留固体的质量应接近于____g。
玻璃管中残留固体的质量应接近于____g。
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸铵简称硝铵,可用作化肥,含氮量高。它在发生某些反应时既放出大量热又生成大量气体而爆炸,也可作炸药使用。
(1)硝铵受热:NH4NO3→N2O↑+2H2O,该反应中因为有____而属于氧化还原反应,其中发生还原过程元素的变化为___。
(2)硝铵受撞击:2NH4NO3→O2+2N2+4H2O,请在该反应方程式上补齐电子转移的方向和数目___。若反应中转移电子数为3.01×1024,则反应产生的气体在标准状况下的体积为____。
(3)一定温度下,硝铵分解:___NH4NO3→___HNO3+___N2↑+___H2O,配平该反应方程式,把系数填入对应的位置上。反应中被氧化与被还原的原子的物质的量之差为5mol时,参加反应的硝铵的质量为___。
(4)硝铵易溶于水,溶解时溶液的温度降低。硝铵溶于水时,温度降低的原因是_____,该水溶液呈(填“酸”“碱”或“中”)____性,用离子方程式表示原因为_____。
(5)为使该水溶液在常温下的pH为7,并不引入杂质,可以_____,试证明所得的溶液中c(NH4+)=c(NO3-):_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com