
科目: 来源: 题型:
【题目】原子序数小于等于36的Q、W、X、Y、Z五种元素原子序数依次增大,其中Q是原子半径最小的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子。回答下列问题(涉及元素时用对应的元素符号表示):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是___。
(2)1molQWX与1molWQ2Y所含σ键的比值为___。
(3)根据等电子体理论可以预测WXY-的空间构型为___。
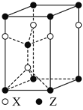
(4)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为___。
(5)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为___。
②该化合物所属晶体类型为___晶体,预测其熔点应___金刚石(填“高于”或“低于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家开发出了多种太阳能电池,除晶体硅太阳能电池外,还有GaAs太阳能电池、铜铟镓硒薄膜太阳能电池等。
(1)基态Ga原子的电子排布式为________。
(2)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因________________。
(3)H2Se分子的键角_______H2O分子的键角(选填“>”、“=”或“<”)。写出与SeO3互为等电子体的一种阴离子_____________(写化学式)。
(4) AsF3分子的立体构型为__________;AsF3是极性分子,理由是_________________。
(5)Ga(OH)3与NaOH溶液反应生成Na[Ga(OH)4]。Na[Ga(OH)4]溶液中含有的化学键有__________________。
A.共价键 B.离子键 C.金属键 D.配位键 E.氢键
(6)金刚砂(SiC)晶胞如图所示:
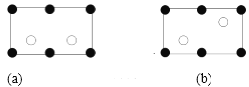
金刚砂中硅原子的杂化轨道类型为_______,沿晶胞图中虚线方向的切面图为__________(填标号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯乙酸(CCl3COOH)是饮用水中常见污染物,难以直接氧化降解。通过Fe/Cu微电池法和芬顿法可将三氯乙酸除去。
(1)pH=4时,向含有三氯乙酸的水样中投入铁屑和铜屑,通过原电池反应生成的活性氢原子(H)将CCl3COOH脱氯后转化为CHCl2COOH。
①原电池反应时的负极反应式为___。
②写出活性氢原子(H)与CCl3COOH反应的离子方程式:___。
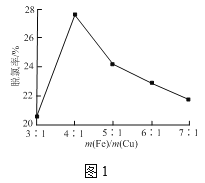
③铁屑和铜屑的总质量一定,改变铁屑和铜屑的质量比,水样中单位时间三氯乙酸的脱氯率如图1所示,当m(Fe)/m(Cu)大于4时,铁屑质量越大,脱氯率越低的原因是___。
(2)取上述反应后的溶液,向其中加入H2O2,发生图2所示转化,生成羟基自由基(·OH),·OH能将溶液中的CHCl2COOH等物质进一步脱氯除去。
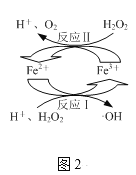
①图2所示转化中化合价未发生变化的元素是___。
②写出图2所示转化中反应Ⅱ的离子方程式:___。
③控制水样的pH不同,所得脱氯率如图3所示,当pH>4后,脱氯率逐渐下降的原因是___。

④加入H2O2后需控制溶液的温度,温度过高时脱氯率减小的原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】以铜片(含少量杂质铁)为原料制取Cu(NO3)2溶液的实验流程如图:

(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式:___。
(2)“水洗”后检验铜片表面是否洗涤干净的方法是___。
(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:
NO+NO2+2OH-=2NO2-+H2O
2NO2+2OH-=NO2-+NO3-+H2O

①“酸溶”时为防止反应过于剧烈,可以采取的方法有___和___。
②通入空气的作用是___、___。
(4)“调节pH=3~4,并保温3个小时”的目的是___。
(5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:___。
[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写均正确的是( )
A.用Cl2与NaOH溶液反应制漂白液:2OH-+Cl2=2ClO-+H2↑
B.SO2通入FeCl3溶液:2Fe3++SO2+2H2O=2Fe2++![]() +4H+
+4H+
C.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3+2Na+
D.H2SO4溶液与Ba(OH)2溶液反应:![]() +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
查看答案和解析>>
科目: 来源: 题型:
【题目】用MnO2为原料可制取电极材料锰酸锂(LiMnxOy),工业上利用菱锰矿粉(MnCO3)制备MnO2的流程如图:
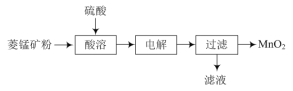
(1)“酸溶”过程中加入过量的硫酸目的是___。
(2)写出“电解”反应的离子反应方程式:___。
(3)为测定LiMnxOy中Mn元素的平均化合价(高于+2价),现进行如下实验:
步骤1:取少量LiMnxOy,分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.400mol·L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol·L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液16.00mL。
步骤3实验过程中物质发生的转化如下,其中C2O42-均转化为CO2:
LiMnxOy![]() Mn2+;MnO
Mn2+;MnO![]()
![]() Mn2+
Mn2+
①步骤3滴定终点时的实验现象是___。
②计算LiMnxOy中Mn元素的平均化合价___(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+等)为原料制备氧化锌的流程如下:
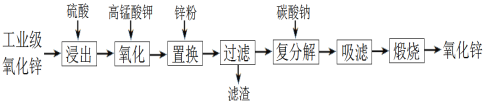
其中“氧化”加入KMnO4是为了除去浸出液中的Fe2+和Mn2+。下列有关说法错误的是
A. 浸出时通过粉碎氧化锌提高了浸出率
B. “氧化”生成的固体是MnO2和Fe(OH)3
C. “置换”加入锌粉是为了除去溶液中的Cu2+、Ni2+等
D. “煅烧”操作用到的仪器:玻璃棒、蒸发皿、泥三角
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H是一种治疗失眠症的药物,其一种合成路线如图:
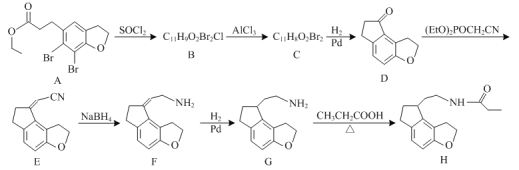
已知:![]()
(1)化合物G中所含官能团的名称为___和___。
(2)G→H的化学反应类型为___反应。
(3)化合物B的结构简式为___。
(4)E的一种同分异构体满足下列条件,写出该同分异构体的结构简式:___。
①含有萘环(![]() );
);
②能发生水解反应,水解所得两种产物中碳原子数之比为3∶10。
(5)写出以![]() 和(EtO)2POCH2CN为原料制备
和(EtO)2POCH2CN为原料制备![]() 的合成路线流程图(无机试剂和有机溶剂任用,合成路线例见本题题干)___。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线例见本题题干)___。
查看答案和解析>>
科目: 来源: 题型:
【题目】以粉煤灰(主要含3Al2O3·2SiO2、SiO2,还含有少量CaO、Fe2O3等物质)为原料制取Al2O3的流程如图:
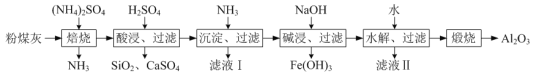
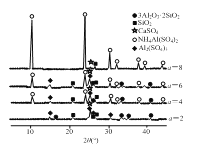
(1)当(NH4)2SO4和3Al2O3·2SiO2的配比a(a=![]() )不同时,“焙烧”后所得产物的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。由图可知,当a=___时,3Al2O3·2SiO2的利用率最高。
)不同时,“焙烧”后所得产物的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。由图可知,当a=___时,3Al2O3·2SiO2的利用率最高。
(2)“沉淀、过滤”所得滤渣为Fe(OH)3和Al(OH)3,生成Fe(OH)3的离子反应方程式为___。
(3)“碱浸”加入NaOH发生反应的离子方程式为___。
(4)“水解、过滤”可得到Al(OH)3沉淀,升高温度有利于水解的原因是___。该步骤可将加水改成通入过量的___气体。
(5)流程中,可以回收并循坏利用的物质除NH3外,还有___和___。
查看答案和解析>>
科目: 来源: 题型:
【题目】向甲、乙两个恒容密闭容器中分别充入一定量的SiHCl3,发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol1,维持容器的温度分别为T1℃和T2℃不变,反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
SiH2Cl2(g)+SiCl4(g) ΔH=+48kJ·mol1,维持容器的温度分别为T1℃和T2℃不变,反应过程中SiHCl3的转化率随时间的变化如图所示。下列说法正确的是( )
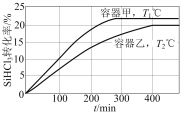
A.T1>T2
B.维持温度不变,向平衡后的乙容器中充入一定量的SiHCl3,平衡不移动
C.T2℃时,反应的平衡常数:K=![]()
D.T1℃时,向甲容器中起始充入0.2molSiHCl3和0.02molSiH2Cl2,SiHCl3的平衡转化率小于10%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com