
科目: 来源: 题型:
【题目】SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。
方法Ⅰ | 用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2 |
方法Ⅱ | 在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4 |
(1)方法Ⅰ的过程如下。
① 制备Al2(SO4)x(OH)y。向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。 CaO的作用是______
② 吸收:Al2(SO4)x(OH)y吸收SO2后的产物是______(写化学式)。
③ 解吸:加热②中产物,产生SO2,Al2(SO4)x(OH)y再生。
(2)方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是______。
(3)方法Ⅱ中,Fe2+的催化过程可表示如下:
ⅰ:2Fe2++O2+SO2=2Fe3++SO42-
ⅱ:……
① 写出ⅱ的离子方程式:______。
② 下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2,滴入KSCN,颜色变红。
c.取b中溶液,______。
(4)方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用如图所示装置滴定,共消耗a mL c mol/L NaOH标准液。

①H2O2氧化SO2的化学方程式______。
② 废气中残留SO2的体积分数为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】读下列药品标签,有关分析不正确的是( )
选项 | A | B | C | D |
物品标签 | 饱和氯水1.01×105 Pa,20 ℃ | 药品:×××
| 碳酸氢钠NaHCO3俗名小苏打(84 g·mol-1) | 浓硫酸H2SO4 密度1.84 g·mL-1浓度98.0% |
分析 | 该试剂应装在橡胶塞的细口瓶中 | 该药品不能与皮肤直接接触 | 该物质受热易分解 | 该药品标签上还标有
|
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】反应3X(g)+Y(g)2Z(g)+2W(g)在 2L密闭容器中进行,10 min后 Y减少了1.0 mol,则此反应的平均速率v为
A.v(X)=0.05mol·L-1·min-1B.v(Z)=0.10mol·L-1·min-1
C.v(Y)=0.10mol·L-1·min-1D.v(W)=0.05mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
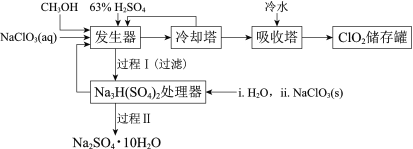
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
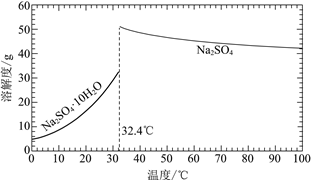
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有c(CH3COOH)+c(CH3COO-)= 0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是( )
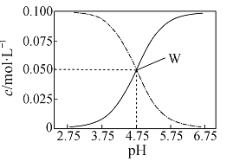
A.pH=5. 5 的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W 点所表示的溶液中:c(Na+)+c(H+)= c(CH3COOH)+c(OH-)
C.pH =3.5的溶液中:c(CH3COOH) + c(CH3COO-)= c(Na+)
D.向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据已经学过的化学知识,回答下列问题。
I.(1)现有下列十种物质:①蔗糖 ②熔融KNO3 ③石墨 ④铜丝 ⑤NaOH固体 ⑥SO3 ⑦BaSO4固体 ⑧K2O固体 ⑨液态H2SO4 ⑩液氯 上述物质中可导电的是____________(填序号,下同);上述物质中不能导电,但属于电解质的是_______________________。
(2)NaHSO4是一种酸式盐,请填写下列空白:
①写出NaHSO4在水中的电离方程式____________________________________。
②与0.1 mol·L—1的NaHSO4溶液的导电能力相同的硫酸钠溶液的物质的量浓度为:_____。
③NaHSO4溶液与NaHCO3溶液反应的离子方程式为______________________________。
(3)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用,①Na2CO3、②NaOH、③BaCl2、④HCl,用序号表示加入的先后顺序依次是_________。
II.A、B、C、X均为中学常见物质,它们在一定条件下有如下转化关系(副产物已略去)。
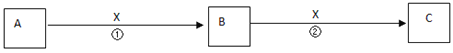
(1)若X是氧气,则A不可能 ______(填序号)
A.C B.SiC.NaD.Mg
(2)若X是金属单质,向浅绿色溶液C中滴入AgNO3溶液,产生了不溶于稀HNO3的白色沉淀,则B的化学式为__________;C溶液在贮存时应加入少量X,理由是(用离子方程式表示)________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各物质转化关系如图所示,气体B为红棕色,C常温时为无色液体,相对分子质量D比B大17,E的原子序数为12。
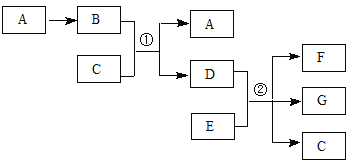
回答下列问题:
(1)A的化学式是 ,C分子的电子式是 。
(2)反应①的离子方程式是 ;若n(E)∶n(D)=2∶5,反应②的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)③、④、⑤的原子半径由大到小的顺序为___(用元素符号回答)。
(2)②、③、⑦的最高价氧化物对应的水化物酸性由强到弱的顺序是___。(用化学式回答)
(3)②、⑧两种元素形成的某化合物是一种常见的有机溶剂,写出该化合物的电子式___。
(5)⑦的最简单氢化物是一种无色气体,遇到空气能发生爆炸性自燃。已知室温下1g该氢化物自燃放出45.0kJ的热量(产物为⑦的氧化物和液态水),其热化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】HI常用作有机反应中的还原剂,受热会发生分解反应。已知![]() 时:
时:![]() ,向1L密闭容器中充入1molHI,
,向1L密闭容器中充入1molHI,![]() 时,体系中
时,体系中![]() 与反应时间t的关系如图所示。下列说法中,正确的是
与反应时间t的关系如图所示。下列说法中,正确的是

A.![]() min内的平均反应速率可表示为
min内的平均反应速率可表示为![]()
![]()
B.升高温度,再次平衡时,![]()
![]()
C.该反应的化学平衡常数计算式为![]()
D.反应进行40min时,体系吸收的热量约为![]() kJ
kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】一种以石墨和过渡金属氧化物做电极材料、以固态有机高聚物做电解质溶剂的锂离子电池,其工作原理如图1所示,图2是合成有机高聚物的单体的结构简式。下列说法中,正确的是

A.放电时,外电路电子由金属氧化物电极流向石墨电极
B.充电时,石墨电极作阳极,过渡金属氧化物作阴极
C.图2所示的两种单体可通过缩聚反应生成有机高聚物溶剂
D.有机高聚物溶剂分子中含醚键和酯基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com