
科目: 来源: 题型:
【题目】下列反应中,水既不做氧化剂又不做还原剂的是
A. 2Na+2H2O=2NaOH+ H2↑B. 2H2O![]() 2H2↑ + O2↑
2H2↑ + O2↑
C. 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑D. 2Na2O2+2H2O=4NaOH+ O2↑
2NaOH+H2↑+Cl2↑D. 2Na2O2+2H2O=4NaOH+ O2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列填空。
(1)在等体积的NaCl、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为______。
(2)将3.22 g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为________g。
(3)在干燥烧瓶中用向下排空气法收集氨气,由于空气不可能排净,所以瓶内气体对氢气的相对密度为9.5,将此瓶气体倒置于水槽中,烧瓶内液面上升的体积占烧瓶总体积的_______。
(4)100 mL 0.3 mol/L Na2SO4(密度为d1 g/cm3)和50 mL 0.2 mol/L Al2(SO4)3(密度为d2 g/cm3)混合,所得密度为d3 g/cm3的混合溶液中SO42的浓度为___________。(用含d1,d2, d3的式子表示)
(5)已知两种碱AOH和BOH的摩尔质量之比为5:7,现将7 mol AOH与5 mol BOH混合后,从中取出5.6 g,恰好可以中和100ml浓度为1.2 mol/L的盐酸,则AOH的摩尔质量为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
① 1 mol PAN中含有的σ键数目为________。PAN中四种元素的第一电离能由大到小的顺序为________________。
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中的中心离子的配位数为________,中心离子的核外电子排布式为________________________。
③ 相同压强下,乙醇的沸点比CH3OCH3________(填“高”或“低”),其原因是_____________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
① (NH4)2SO4晶体中各种微粒间的作用力不涉及________(填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
② NH4NO3中阳离子的空间构型为________,阴离子的中心原子轨道采用________杂化。
(3)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如下图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=____________(填数字)。
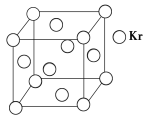
查看答案和解析>>
科目: 来源: 题型:
【题目】用容量瓶配制一定物质的量浓度的NaCl溶液的实验中,会使所配溶液浓度偏高的是
A. 称量NaCl固体时砝码上有杂质
B. 没有洗涤溶解NaCl固体的烧杯和玻璃棒
C. 定容时加水加多了,用滴管吸出溶液至刻度线
D. 定容时仰视刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯度氧化铝(Al2O3)的用途很广。实验室用(NH4)2SO4、H2O2、氨水、Al2(SO4)3为原料,通过以下过程制备Al2O3:
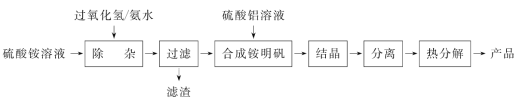
(1)“除杂”操作是加入H2O2后,用氨水调节溶液的pH约为3,以除去硫酸铵溶液中少量的Fe2+。
① 酸性溶液中Fe2+与H2O2反应的离子方程式为________________________________。
② 滤渣的化学式为__________。
③ 检验“过滤”后杂质是否除尽的实验方法是____________________________________。
(2) 配制Al2(SO4)3溶液时,需用硫酸酸化的目的是_______________________________。
(3) 铵明矾[NH4Al(SO4)2·12H2O]强热分解的产物为Al2O3、NH3、N2、SO3、SO2和H2O。该反应氧化产物与还原产物的物质的量之比为__________。
(4)强热分解需用酒精喷灯,另外还需用到的硅酸盐质仪器有______(填标号)。
a 烧杯 b 坩埚 c 玻璃棒 d 泥三角
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。

(1)装置③的作用是______________________________。
(2)装置②中产生ClO2的化学方程式为________________________________。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③______________;④低于60 ℃干燥,得到成品。
(4)装置①、⑤的作用是______________________________。
(5)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象:取少量晶体溶于蒸馏水,___________________________________。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+===2H2O+2I2+Cl-)。将所得混合液配成100 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2+2S2O32-===2I-+S4O62-)。
(6)滴定中使用的指示剂是______________,达到滴定终点时的现象为__________。
(7)样品中NaClO2的质量分数为______________(用含m、c、V的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】用200 mL 1 mol/L 氯化铝溶液与一定量 3 mol/L的氢氧化钠溶液混合,可得到氢氧化铝7.8g,请计算需要此氢氧化钠溶液的体积为多少毫升?(写计算步骤)________
查看答案和解析>>
科目: 来源: 题型:
【题目】现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图。
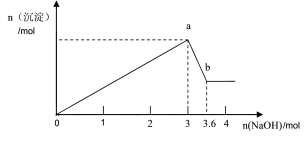
(1)a点对应的沉淀为________________(填化学式)。
(2)计算原混合液中FeCl3的物质的量浓度为多少_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】磷化硼是一种超硬耐磨涂层材料,右图为其晶胞,其中的每个原子均满足8电子稳定结构。
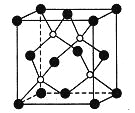
下列有关说法正确的是( )
A. 磷化硼晶体的熔点很低
B. 磷化硼晶体的化学式为BP,属于离子晶体
C. 磷化硼晶体中每个原子均形成4条共价键
D. 磷化硼晶体结构中微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com