
科目: 来源: 题型:
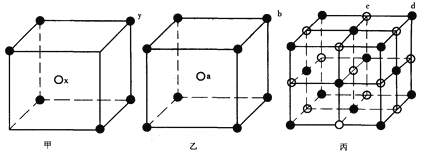
【题目】现有甲、乙、丙(如下图)三种晶体的晶胞(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶胞中x与y的个数比是__________,乙晶胞中a与b的个数比是__________,丙晶胞中有________个c离子,有________个d离子。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)比较结合e-能力的相对强弱:Cl2__________S(填“>”或“<”);用一个离子方程式说明Cl2和S结合e-能力的相对强弱_______。
(2)KCN 是离子化合物,各原子均满足8 电子稳定结构。写出 KCN的电子式______。
(3)在常压下,CBr4的沸点(190℃)比CCl4的沸点(76.8℃)高。主要原因是 ____ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】新型材料 AIN 应用前景广泛,对其制备过程的研究成为热点。
(1)将物质的量均为a mol 的 Al2O3与N2 充入恒温恒容密闭容器中,控制温度发生反应:2Al2O3(s)+2N2(g) ![]() 4AlN(s) +3O2(g) △H>0。
4AlN(s) +3O2(g) △H>0。
①下列可作为反应达到平衡的判据是_________(填序号)。
A.固体的质量不再改变
B.2v正(N2)=3v逆(O 2)
C.△H 不变
D.容器内气体的压强不变
E.N2分子数与 O2 分子数比为 2:3
②在起始压强为p的反应体系中,平衡时 N2的转化率为α,则上述反应的平衡常数 Kp__________(对于气相反应,用某组分 B 的平衡压强 p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B) =p总·x(B) ,p总为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③为促进反应的进行,实际生产中需加入焦炭,其原因是____________。
(2)铝粉与 N2 在一定温度下可直接生成 AlN, 加入少量 NH4Cl 固体可促进反应。将等质量的A1粉与不同量的 NH4Cl混合均匀后置于充 N2的密闭容器中,电火花引燃,产品中 AlN的质量分数[ω(AlN)] 随原料中ω(NH4Cl)的变化如图1所示,燃烧过程中温度随时间变化如图2所示。则:
①固体混合物中,ω(NH4Cl)的最佳选择是__________。
②结合图2解释当ω(NH4Cl)超过一定值后,ω(AlN)明显减少的原因__________。

(3)AIN粉末会缓慢发生水解反应,粒径为100 nm 的 AlN 粉末水解时溶液 pH的变化如图3 所示。

①AlN 粉末水解的化学方程式是______________。
②相同条件下,请在图3中画出粒径为40 nm 的AlN粉末水解的变化曲线____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.治疗胃酸过多的药物达喜(其式量不超过 700)由五种短周期元素组成,按如下流程进行实验以确定其组成。
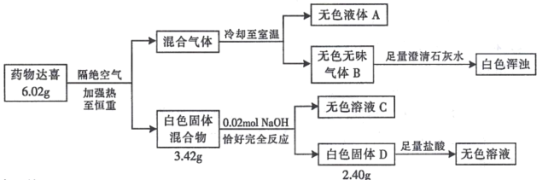
请回答:
(1)达喜的化学式是_____________。
(2)达喜与胃酸(含稀盐酸)反应的化学方程式是____________。
(3)气体 B 与环氧丙烷(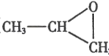 )可制得一种可降解高聚物,该反应的化学方程式是_____________________(有机物用结构简式表示)。
)可制得一种可降解高聚物,该反应的化学方程式是_____________________(有机物用结构简式表示)。
II.将 NaC1O3 溶液逐滴加入到碘单质和过量盐酸的混合液中可制备液态 ICl,实验装置如下图:
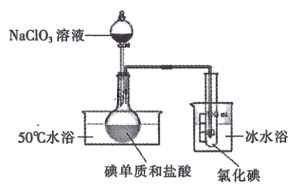
请回答:
(1)圆底烧瓶中发生的化学反应是______________( 用化学方程式表示)。
(2)若加入的 NaClO3 溶液已足量,请设计实验方案证明该反应已完全:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】今有A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中电负性最大。
(1)试推断A、B、C、D四种元素的符号:A________、B________、C________、D________。
(2)写出A元素原子的核外电子排布式:____________;写出B元素原子核外电子排布的价电子构型:__________;用电子排布图表示C原子的核外电子排布情况:_______________。
(3)比较四种元素的第一电离能和电负性的大小:第一电离能____________;电负性____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CaCl2固体遇 NH3会形成 CaCl2 8 NH3(可溶于水)。下列说法不正确的是
A.CaCl2 作干燥剂时,不能干燥 NH3
B.CaCl2 8 NH3溶于水,溶液呈中性
C.CaCl2 8 NH3溶于水,通少量CO2 会产生白色沉淀
D.CaCl2 与 NH3形成CaCl2 8 NH3的过程属于化学变化
查看答案和解析>>
科目: 来源: 题型:
【题目】在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,
(1) ______ 元素被氧化, ______ 是氧化剂;
(2) ______ 是氧化产物, ______ 发生氧化反应;
(3)被还原的HNO3与参加反应的HNO3物质的量之比是 ______;
(4)用双线桥标出该反应电子转移的方向和数目:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O_________________;
(5)当有8mol HNO3被还原时,反应转移___________个电子;
(6)写出该反应的离子反应方程式___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用碳酸钠晶体配制1.00mol/L的Na2CO3溶液100mL,造成所配溶液浓度偏高的原因是( )
A. 烧杯和玻璃棒没有洗涤
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 称量碳酸钠晶体(Na2CO310H2O)的烧杯未干燥
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,用0.200molL-1盐酸滴定 20.00mL 0.200 molL-1 的 NaY 溶液,溶液中水的电离程度随所加盐酸的体积变化如图所示(忽略滴定过程中溶液体积变化),则下列有关说法正确的是[已知 Ka(HY)=5.0×10-11]

A.可选取酚酞作为滴定指示剂B.M 点溶液的 pH>7
C.Q 点水的电离程度最小,Kw<l0-14D.M点,c(Na+)=c (HY)+c (Y-)+c (Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com