
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A.常温常压下,22.4LCl2含有的分子数目为NA
B.1.00mol/LCa(NO3)2溶液中含有的NO3- 离子数目为2NA
C.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
D.1molO2与足量Na反应,生成Na2O和Na2O2的混合物转移的电子数为 2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是
A.H2O+CaO=Ca(OH)2
B.2H2O+2F2=4HF+O2
C.2H2O![]() O2↑+2H2↑
O2↑+2H2↑
D.3NO2+ H2O=2HNO3+NO
查看答案和解析>>
科目: 来源: 题型:
【题目】利用碳酸钠晶体(Na2CO3·10H2O,相对分子质量286)来配制0.1mol/L的碳酸钠溶液980mL,假如其他操作均准确无误,下列情况会引起配制溶液的浓度偏高的是
A. 称取碳酸钠晶体28.6g
B. 溶解时进行加热,并将热溶液转移到容量瓶中至刻度线
C. 转移时,对用于溶解碳酸钠晶体的烧杯没有进行洗涤
D. 定容后,将容量瓶振荡摇匀,静置发现液面低于刻度线,又加入少量水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() (连二亚硫酸钠)是易溶于水,不溶于甲醇的白色固体,在空气中极易被氧化,是一种还原性漂白剂。制取
(连二亚硫酸钠)是易溶于水,不溶于甲醇的白色固体,在空气中极易被氧化,是一种还原性漂白剂。制取![]() 的方法很多,
的方法很多,
(1)在碱性溶液中用![]() 还原
还原![]() 法制备
法制备![]() 的反应原理为:
的反应原理为:![]() (未配平)反应装置如图所示:
(未配平)反应装置如图所示:
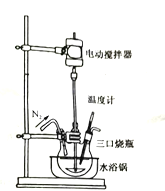
①实验开始及整个过程中均需通入![]() ,其目的是__________________________________。
,其目的是__________________________________。
②制备过程中温度需控制在10~45℃,采用水浴加热的主要优点是______________________。
③为使![]() 尽可能完全被还原,加入三口烧瓶中的反应液,应控制
尽可能完全被还原,加入三口烧瓶中的反应液,应控制![]() ______________。
______________。
(2)用![]() 还原
还原![]() 制备
制备![]() 的装置(夹持加热仪器略)如下:
的装置(夹持加热仪器略)如下:
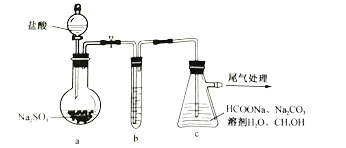
①装置a烧瓶中发生反应的化学方程式为_________________________________。
②装置b用于净化![]() ,适宜的试剂是______________________________。
,适宜的试剂是______________________________。
③装置c在70~83℃生成![]() 并析出,同时逸出
并析出,同时逸出![]() ,该反应的化学方程式为________________________,加入
,该反应的化学方程式为________________________,加入![]() 的目的是________________________;利用反应后的浊液分离提纯
的目的是________________________;利用反应后的浊液分离提纯![]() 需经过的操作为_____________________________________________________。
需经过的操作为_____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。某兴趣小组采用10.0 g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如图1:
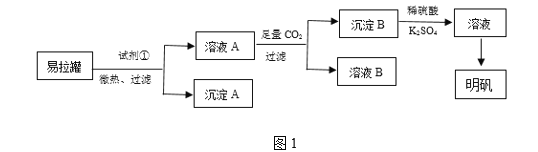
(1)试剂①应选用________(填代号)。
a.盐酸 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为__________。通入足量二氧化碳发生的反应的离子方程式___________________________。
(3)沉淀B为_____(填化学式),溶液B中溶质的主要成分为________(填化学式)。
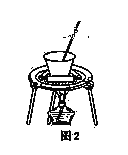
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、________(填操作名称)、过滤、洗涤、干燥。如图2所示,蒸发操作中的一处错误是______________。
(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为________。(已知:明矾的摩尔质量为474 g·mol-1)
查看答案和解析>>
科目: 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | Si | SiO2 | H2SiO3 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:

(1)工业生产纯碱的第一步是除去饱和食盐水的中SO42-、Ca2+离子,依次加入的试剂及其用量是______________、_______________、过滤、_______________。
(2)已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
①写出装置I中反应的化学方程式_____________________________________。
②写出装置II中发生反应的化学方程式________________________________。
(3)该流程中可循环利用的物质是__________________。
(4)若制出的纯碱中只含有杂质NaCl。
①检验用该纯碱配制的溶液中含有Cl―的方法是_________________________。
②向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g,则该纯碱的纯度(质量分数)为__________(用m、b来表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 等均是我国发明的深紫外非线性光学晶体。
等均是我国发明的深紫外非线性光学晶体。
(1)![]() 三种元素的电负性由大到小的顺序是__________________,
三种元素的电负性由大到小的顺序是__________________,![]() 的第一电离能从大到小的顺序是______________________。
的第一电离能从大到小的顺序是______________________。
(2)基态钾原子的核外电子排布式为____________________;![]() 的熔点比
的熔点比![]() 的低,其原因是___________________________________________。
的低,其原因是___________________________________________。
(3)![]() 溶于25%的
溶于25%的![]() 溶液中,在铂制或铅制器皿中浓缩可得四氟铍酸铵
溶液中,在铂制或铅制器皿中浓缩可得四氟铍酸铵![]() 晶体,再在
晶体,再在![]() 气流中加热至450℃可得
气流中加热至450℃可得![]() 。
。
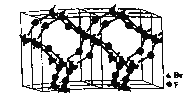
①气态![]() 是以单分子
是以单分子![]() 存在,固态
存在,固态![]() 的结构如图所示,气态
的结构如图所示,气态![]() 与固态
与固态![]() 的中心原子杂化方式依次为_____________、_________________。
的中心原子杂化方式依次为_____________、_________________。
②![]() 的空间构型为________________,画出
的空间构型为________________,画出![]() 的结构:_______________________.
的结构:_______________________.
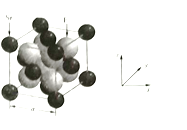
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,![]() 晶胞结构如图所示,品胞中与点
晶胞结构如图所示,品胞中与点![]() 距离最远的
距离最远的![]() 的原子分数坐标为_______________;
的原子分数坐标为_______________;![]() 的摩尔质量为
的摩尔质量为![]() ,晶胞的密度为
,晶胞的密度为![]() ,则晶胞参数
,则晶胞参数![]() ____________pm(用代数式表示)
____________pm(用代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列流程回答:
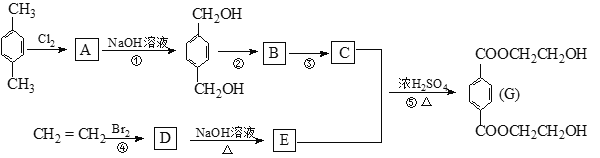
(1) 写出结构简式 C______ E_________。
(2)指出反应类型: ① ___________ ③ _____________ ⑤ ____________
(3)写出化学方程式 C + E ![]() G____________
G____________
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 广泛存在于天然气等燃气及废水中,热分解或氧化
广泛存在于天然气等燃气及废水中,热分解或氧化![]() 有利于环境保护并回收硫资源。
有利于环境保护并回收硫资源。
(1)Binoist等进行了![]() 热分解实验:
热分解实验:![]() ,开始时,
,开始时,![]() 与
与![]() 的体积比为1:19.在压强为
的体积比为1:19.在压强为![]() 下测得在三种不同温度下
下测得在三种不同温度下![]() 的转化率如图1所示.
的转化率如图1所示.
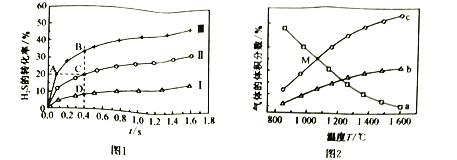
![]() 分解反应的
分解反应的![]() ______________(填“>”或“<”)0,A、B、C、D四点中:
______________(填“>”或“<”)0,A、B、C、D四点中:![]() 最大的是__________________,
最大的是__________________,![]() 最大的是___________,容器中
最大的是___________,容器中![]() 的分压由大到小的关系是__________________。
的分压由大到小的关系是__________________。
(2)当![]() 与
与![]() 混合,在
混合,在![]() 及不同温度下反应达平衡时
及不同温度下反应达平衡时![]() 及
及![]() 的体积分数如图2所示。图中b表示的物质是___________,M点时,反应
的体积分数如图2所示。图中b表示的物质是___________,M点时,反应![]() 的平衡常数
的平衡常数![]() ____________________
____________________![]() (
(![]() 为以分压表示的平衡常数,保留两位小数)
为以分压表示的平衡常数,保留两位小数)
(3)用氯气除去废水中![]() 的反应为
的反应为![]() ,该反应的可能机理如下:
,该反应的可能机理如下:
a.![]() 慢 b.
慢 b.![]() 快
快
![]() 快
快 ![]() 慢
慢
![]() 快
快 ![]() 快
快
c.![]() 慢 d.
慢 d.![]() 快
快
![]() 快
快 ![]() 慢
慢
①机理a的中间体为______________________。
②已知![]() ,
,![]() 为正反应速率,k为速率常数,上述机理中与该速率方程一致的是_________________________(填字母)。
为正反应速率,k为速率常数,上述机理中与该速率方程一致的是_________________________(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com