
科目: 来源: 题型:
【题目】合成聚丙烯腈纤维的方法很多,如以乙炔为原料,其合成过程的化学反应方程式如下:
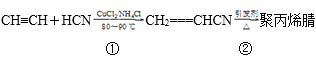
(1)反应①的反应类型为___。
(2)写出反应②的化学方程式:___,其反应类型为__。
(3)1mol合成聚丙烯腈的单体在一定条件下最多能与___molH2加成。
(4)CH2===CHCN在一定条件下可与苯乙烯(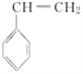 )反应得到一种优良的塑料,该塑料的结构简式为___。
)反应得到一种优良的塑料,该塑料的结构简式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于物质用途的叙述中不正确的是
A.过氧化钠可用于呼吸面具或潜水艇中作为氧气的来源
B.在常温下可用铝制容器贮藏运输浓硫酸
C.Al(OH)3可作治疗胃酸过多的一种药剂
D.Al2O3 和MgO是较好的耐火材料,两者均易与NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
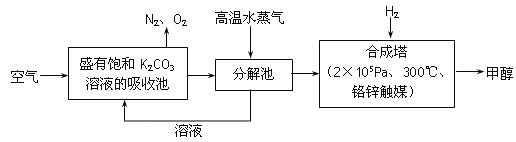
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式是______________________________________。
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:
CH3OH + H2O - 6e-=== CO2 + 6H+
则正极发生的反应是__________;放电时,H+移向电池的______(填“正”或“负”)极。
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+ 的平衡常数K=_____________。(已知:10-5.6=2.5×10-6)
HCO3-+H+ 的平衡常数K=_____________。(已知:10-5.6=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)________c(CO32-) (填“>”、“=”或“<”),原因是________________________(用离子方程式和必要的文字说明)。
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小李应该选用的试剂是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有以下物质相互转化,其中A为常见金属,C为碱。
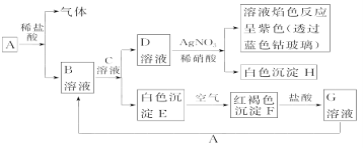
试回答:
(1)写出F的化学式_______________,H的化学式___________________。
(2)写出由E转变成F的化学方程式:_________________________________。
(3)向G溶液加入A的有关反应离子方程式:____________________。
(4)写出A在一定条件下与水反应的化学方程式并用双线桥标出该反应的电子转移情况__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下,Ksp(NiS)≈1.0×10-21,Ksp(ZnS)≈1.0×10-25,pM=-lgc(M2+)。向20mL0.1mol·L-1NiCl2溶液中滴加0.1mol·L-1Na2S溶液,溶液中pM与Na2S溶液体积的关系如图所示,下列说法正确的是( )
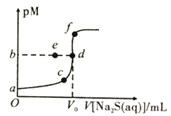
A.图像中,V0=40,b=10.5
B.若NiCl2(aq)变为0.2mol·L-1,则b点向a点迁移
C.若用同浓度ZnCl2溶液替代NiCl2溶液,则d点向f点迁移
D.Na2S溶液中存在c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:

(1)A中含氧官能团的名称为________和________。
(2)A→B的反应类型为________。
(3)C→D的反应中有副产物X(分子式为C12H15O6Br)生成,写出X的结构简式:________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)相同物质的量的钠、镁、铝与足量盐酸反应时放出氢气的体积比为__________。相同质量的钠、镁、铝与足量盐酸反应时放出氢气的体积比是_________。分别为0.3 mol的钠、镁、铝投入100 mL 1 mol·L-1的硫酸溶液中,三者产生的体积比是______________。
(2)在一个用铝制的易拉罐内充满CO2气体,然后往罐内注入足量的NaOH溶液,立即用胶布密封罐口。经过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起来。
罐壁内凹而瘪的原因是______________________,离子方程式可能为____________________________;
罐再鼓起的原因是___________________________,离子方程式可能为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制98 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为 ______ mL。
(2)实验时选用的仪器有(填序号)_______
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)_____
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)_______
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目: 来源: 题型:
【题目】现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为____________个;
(2)该气体在标准状况下的体积为____________L;
(3)该气体每个分子的质量为_______________g;
(4)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为____________mol/L。
查看答案和解析>>
科目: 来源: 题型:
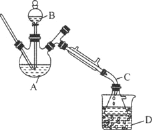
【题目】乙醚是有机合成中常用的溶剂。某实验小组在实验室利用乙醇脱水制备乙醚,装置示意图(夹持和加热装置已略去)、有关数据和实验步骤如下:
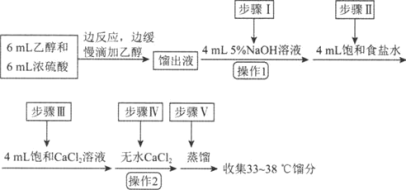
物质 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 在水中的溶解性 |
乙醇 | 46 | 0.816 | 78 | 互溶 |
乙醚 | 74 | 0.713 | 34.6 | 不溶 |
已知:①相同条件下,乙醚在饱和食盐水中比在水中更难溶。
②氯化钙可与乙醇形成络合物CaCl2·6C2H5OH。
请回答下列问题:
(1)仪器B的名称为________。
(2)由乙醇制备乙醚的总反应为2C2H5OH![]() CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4
CH3CH2OCH2CH3+H2O,此反应分两步进行,第一步反应的化学方程式为:CH3CH2OH+H2SO4![]() CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为________。
CH3CH2OSO2OH+H2O,则第二步反应的化学方程式为________。
(3)反应过程中,仪器B的末端应浸入反应液中,原因是________________。
(4)仪器D中盛有冰水混合物,其作用为________________。
(5)操作1的名称为________,操作2的名称为________。
(6)若省略步骤Ⅱ会导致的后果是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com