
科目: 来源: 题型:
【题目】已知反应4CuO![]() 2Cu2O+O2↑,关于该反应的叙述不正确的是
2Cu2O+O2↑,关于该反应的叙述不正确的是
A. 固体的颜色由黑色变为红色
B. 铜元素被还原,氧元素部分被氧化
C. 16 g氧化铜分解时转移电子0.2 mol
D. 可说明热稳定性:氧化铜>氧化亚铜
查看答案和解析>>
科目: 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目: 来源: 题型:
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置看,图中尚缺少的一种玻璃用品是_______________。
(2)两烧杯间填满碎纸条的作用是________________________。
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量________(填“相等”或“不相等”),中和热__________(填“相等”或“不相等”),理由是_____________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会____________(填“偏大”、“偏小”或“无影响”)。
(5)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价——物质类别关系图如下。
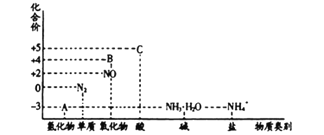
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是:__________
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式: _______________;
(3)实验室中,检验溶液中含有NH4+的操作方法是: __________________________;
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式_____________,当反应消耗3.36L (标准状况) 物质B时,转移电子的物质的量为__________________________。
(5)将32g铜与140 mL一定浓度的C溶液反应,铜完全溶解产生的气体在标准状况下的体积为11.2L。
①参加反应的C的物质的量为__________________________;
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1 的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原C溶液的浓度为________ mol·L-1
③欲使铜与C反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通入O2_____mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
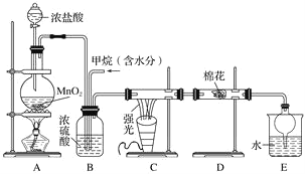
试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学方程式:___________________________________。有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或“不正确”)。
(2)B装置有三种功能:①控制气流速率;②混匀混合气体;③________________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
a.分液法 b.蒸馏法 c.结晶法
(5)将1 mol CH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1 mol,则参加反应的Cl2的物质的量为________,生成HCl的总物质的量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组为了证明二氧化硫和氯气的漂白性,设计了如下图所示的实验装置:
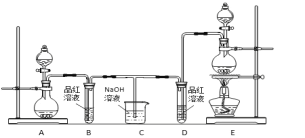
他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4 = Na2SO4+H2O+SO2↑
MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用来制取氯气的装置是______(填字母),反应中浓盐酸所表现出________________性质。
(2)反应开始一段时间后,B、D试管中的品红溶液均退色。停止通气后,再给B、D两个试管分别加热____ (填" B”或“D")试管中无明显现象。
(3)装置C的作用是________________________;
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是____________________________;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不退色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是:________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】饮用水质量是关系人类健康的重要问题。
(1)Cl2是最早用于饮用水消毒的物质,写出Cl2溶于水发生反应的离子方程式________________。
(2)C1O2是一种高效、低毒的消毒剂,逐渐取代Cl2成为生产自来水的消毒剂。KClO3与SO2在强酸性溶液中反应可制得C1O2,此反应的离子方程式为_________________。ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为___________。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,比Cl2、ClO2氧化性更强,无二次污染的绿色水处理剂。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾。由以上信息可知,相同条件下,高铁酸钠溶解度比高铁酸钾溶解度______ (填“大”或“小”)。干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应每生成1 molNa2FeO4转移____mol电子。
(4)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是_______。该图示的总反应为 ______。
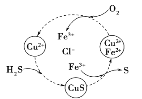
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:

(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:___________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为:![]() 。下列说法正确的是()
。下列说法正确的是()
A.题述反应条件下还原性:CO>Pd
B.题述反应中PdCl2被氧化
C.生成22.4 L CO2时,转移的电子为2 mo1
D.CO气体只有在高温下才能表现还原性
查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳”既是时尚,也是环保要求。“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式。下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:

请回答下列问题:
(1)工艺操作①、②分别为____________、____________。
(2)工业合成氨的化学方程式为:__________。
(3)写出生成“产品”的离子方程式:________。
(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是______________。
(5)副产品的化学式为________________。该联合生产工艺中可以循环使用的物质是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com