
科目: 来源: 题型:
【题目】元素X的单质及X与Y形成的化合物能按下图所示的关系发生转化(其中m、n均为正整数,且m≠n)。下列说法正确的是
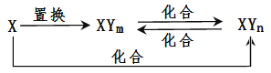
A.X一定是多价态金属元素
B.X一定是非金属元素
C.XYm与XYn的相互转化属于可逆反应
D.X、Y均为非金属元素,也可以实现上述转化
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:KClO3+6HCl=KCl+3Cl2↑+3H2O。下列结论正确的是
A.氧化性:Cl2>KClO3
B.HCl作还原剂,全部被氧化
C.KClO3 作氧化剂,具有氧化性
D.生成3 mol Cl2 ,转移电子的物质的量为6 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】某铜合金中Cu的质量分数为80%~90%,还含有Fe等。通常用间接碘量法测定其中Cu的含量,步骤如下:
Ⅰ.称取a g样品,加入稀H2SO4和H2O2溶液使其溶解,煮沸除去过量的H2O2,冷却后过滤,滤液定容于250 mL容量瓶中;
Ⅱ.取50.00 mL滤液于锥形瓶中,加入NH4F溶液,控制溶液pH为3~4,充分反应后,加入过量KI溶液,生成白色沉淀,溶液呈棕黄色;
Ⅲ.向Ⅱ的锥形瓶中加入c mol·L1 Na2S2O3溶液滴定,至锥形瓶中溶液为浅黄色时,加入少量淀粉溶液,继续滴至浅蓝色,再加入KSCN溶液,剧烈振荡后滴至终点;
Ⅳ.平行测定三次,消耗Na2S2O3溶液的体积平均为v mL,计算铜的质量分数。
已知:ⅰ.F与Fe3+生成稳定的FeF63(无色)。
ⅱ.I2在水中溶解度小,易挥发。
ⅲ.I2+I I3(棕黄色)。
ⅳ.I2+2Na2S2O3== 2NaI+Na2S4O6(无色)。
(1)Ⅰ中Cu溶解的离子方程式是__________________________。
(2)Ⅱ中Cu2+和I反应生成CuI白色沉淀和I2。
①加入NH4F溶液的目的是__________________________。
②Cu2+和I反应的离子方程式是_________________________。
③加入过量KI溶液的作用是________________________________。
(3)室温时,CuSCN的溶解度比CuI小。CuI沉淀表面易吸附I2和I3,使测定结果不准确。Ⅲ中,在滴定至终点前加入KSCN溶液的原因是_。
(4)样品中Cu的质量分数为______(列出表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A.Al(OH)3溶于足量的NaOH溶液:Al(OH)3+OH-=AlO2-+2H2O
B.Na2O2与H2O反应:Na2O2+H2O=2Na++2OH-+O2↑
C.氯气与水的反应:Cl2+H2O=2H++Cl-+ClO-
D.盐酸中滴加氨水:H++OH-=H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式书写正确的是
A. 2SO2 + O2![]() 2SO3 △H=-196.6 kJ·mol-1
2SO3 △H=-196.6 kJ·mol-1
B. C(s) + O2(g) = CO2(g) △H=393.5 kJ·mol-1
C. H+(aq) + OH-(aq) = H2O(l) △H=57.3 kJ
D. ![]() H2(g) +
H2(g) + ![]() Cl2(g) = HCl(g) △H=-92.5 kJ·mol-1
Cl2(g) = HCl(g) △H=-92.5 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】研究1,3-丁二烯和Br2以物质的量之比为1∶1加成时的反应:
![]() ;
;![]()
文献:Ⅰ.一般情况,在相同条件下,化学反应的活化能(E)越大,化学反应速率越小。
Ⅱ.1,3-丁二烯和Br2以物质的量之比为1∶1加成时的反应过程和能量变化的示意图如下:

(1)已知:
![]() ΔH1=-a(a>0) kJ·mol1 ;
ΔH1=-a(a>0) kJ·mol1 ; ![]() ΔH2=+c(c>0) kJ·mol1
ΔH2=+c(c>0) kJ·mol1
①稳定性:A ______ B(填“>”、“=”或“<”)。
②气态1,3-丁二烯和液态Br2以物质的量之比为1∶1加成生成液态B的热化学方程式是______。
(2)探究1,2-加成和1,4-加成的影响因素。
实验1 将1,3-丁二烯和Br2以物质的量之比1∶1加成,不同温度,相同时间内测定A和B在产物中的含量,低温时产物以A为主,较高温时以B为主。
实验2 加热实验1中低温时的反应产物,A的含量减少,B的含量增大。
实验3 在实验1的基础上,充分延长反应时间,无论是低温还是高温,产物中B的含量均增大。
①结合反应过程和能量变化的示意图,解释实验1中低温时产物以A为主的原因:______。
②说明实验2中,升高温度,A转化为B经历的物质转化过程:______。
③综上所述,有利于1,4加成的措施是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某炼锌厂利用含ZnO的烟尘脱除硫酸工艺烟气中的SO2制ZnSO4。
已知:Ⅰ.ZnSO3·![]() H2O微溶于水,ZnSO4易溶于水。
H2O微溶于水,ZnSO4易溶于水。
Ⅱ.25℃时,溶液中S(+4价)各组分的物质的量分数随pH变化曲线如下图。
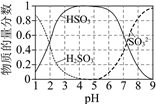
Ⅲ.O3为强氧化剂,1 mol O3被还原转移2 mol e,同时生成1 mol O2。
(1)SO2造成的环境问题主要是_____________________。
(2)ZnO将SO2转化为ZnSO3·![]() H2O的化学方程式是_____________________________。
H2O的化学方程式是_____________________________。
(3)将ZnSO3·![]() H2O悬浊液转化为ZnSO4时,因其被O2氧化的速率很慢,易造成管道堵塞,实验室模拟O3氧化解决该问题。初始时用盐酸将5% ZnSO3悬浊液调至 pH=3.5,以一定的进气流量通入O3,研究O3氧化ZnSO3·
H2O悬浊液转化为ZnSO4时,因其被O2氧化的速率很慢,易造成管道堵塞,实验室模拟O3氧化解决该问题。初始时用盐酸将5% ZnSO3悬浊液调至 pH=3.5,以一定的进气流量通入O3,研究O3氧化ZnSO3·![]() H2O,其中溶液pH随时间变化的曲线如下:
H2O,其中溶液pH随时间变化的曲线如下:

①pH=3.5的溶液中含S(+4价)的离子主要是____________________。
②一段时间后,溶液的pH减小,此过程中主要反应的离子方程式是________________。
③解释O3氧化可防止管道堵塞的原因:___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.已知2C+SiO2![]() Si+2CO↑,说明Si的非金属性比C强
Si+2CO↑,说明Si的非金属性比C强
B.电子层数越多,原子半径一定越大
C.碱金属元素都能与氧气反应生成过氧化物
D.单质中不可能含有离子键
查看答案和解析>>
科目: 来源: 题型:
【题目】如图曲线表示其他条件一定时,反应2NO+O2![]() 2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()

A.a点B.b点C.c点D.d点
查看答案和解析>>
科目: 来源: 题型:
【题目】高温下铝粉与氧化铁的反应可以用来焊接钢轨,该反应会放出大量的热,使置换出的铁呈熔融态,从而达到焊接目的。下列分析错误的是
A.该反应不属于氧化还原反应
B.被还原的物质是氧化铁
C.该反应的还原剂是铝粉
D.该反应可以用来冶炼某些熔点高的金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com