
科目: 来源: 题型:
【题目】铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①![]()
![]()
②![]()
![]()
③断裂![]() 气体中的化学键需要吸收1076kJ的能量,断裂
气体中的化学键需要吸收1076kJ的能量,断裂![]() 气体中的化学键需要吸收1490kJ的能量。
气体中的化学键需要吸收1490kJ的能量。
请回答:
(1)断裂![]() 中所有化学键需要吸收的能量为________kJ。
中所有化学键需要吸收的能量为________kJ。
(2)T1℃时,向密闭容器中加入一定量的![]() 和C,发生反应①,达到平衡后
和C,发生反应①,达到平衡后![]() 的浓度为
的浓度为![]() ;其他条件不变,缩小容器体积,再次达到平衡时,
;其他条件不变,缩小容器体积,再次达到平衡时,![]() 的浓度为
的浓度为![]() ,则a________b(选填“>”“<”或“=”)。
,则a________b(选填“>”“<”或“=”)。
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的![]() 和CO发生反应②,测得相关数据如表所示:
和CO发生反应②,测得相关数据如表所示:
编号 | 容器 | 起始时物质的量/mol | 平衡时物质的量/mol | 平衡常数(K) | |
|
|
| |||
1 | 恒温 | 0.5 | 1.5 | 0.8 K1 | |
2 | 恒温 | 2 | 3 | M | K2 |
3 | 绝热 | 1 | 1.5 | n | K3 |
①T2℃时,容器1中反应的平衡常数K1=_______。
②容器2中,5min达到平衡,则0~5min以![]() 表示该反应的速率
表示该反应的速率![]() ___________。
___________。
③对于三个容器中的反应,下列说法正确的是(填字母)_________。
A.![]() B.容器1和容器2中
B.容器1和容器2中![]() 的平衡转化率
的平衡转化率![]()
C.![]() D.平衡时气体压强:
D.平衡时气体压强:![]()
(4)一定条件下,向恒压密闭容器中充入0.5mol ![]() 和1.0mol CO,发生反应②,CO和
和1.0mol CO,发生反应②,CO和![]() 的物质的量浓度(c)与时间(t)的关系如图所示:
的物质的量浓度(c)与时间(t)的关系如图所示:

①6min时改变的外界条件为________________。
②若在6min时,恒温将容器体积扩大到10L,请在图中画出6~10min![]() 的物质的量浓度随时间变化的曲线_________。
的物质的量浓度随时间变化的曲线_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2反应 B. 氧化铁与铝反应
C. 钠与乙醇反应 D. Ba(OH)2·8H2O与NH4C1反应
查看答案和解析>>
科目: 来源: 题型:
【题目】用MnO2和浓盐酸制取纯净干燥的氯气,并让氯气与铜粉反应制取纯净的无水CuCl2,装置如图所示。
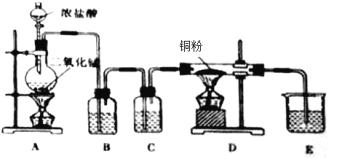
回答下列问题:
(1)写出在A中发生反应的化学方程式为:__;
(2)B中选用的试剂是__,其作用是__;
(3)E中选用的试剂是__,其作用是__;
(4)若用含有0.2molHCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝灰是铝加工行业的废渣,可能含有Al、![]() 、KCl、FeO、
、KCl、FeO、![]() 、MgO、
、MgO、![]() 、
、![]() 中的若干种。为了确认其成分,某同学依次进行了以下实验:
中的若干种。为了确认其成分,某同学依次进行了以下实验:
①将过量的稀盐酸加入铝灰中,充分反应后过滤得到溶液甲和固体乙;
②取少量溶液甲滴加![]() 溶液,生成白色沉淀;
溶液,生成白色沉淀;
③取少量溶液甲滴加KSCN溶液,溶液变成血红色;
④取少量溶液甲加入过量NaOH溶液,置于空气中充分反应后,经过滤、洗涤、灼烧得到1.60g固体丙,将固体丙置于氢气流中加热充分反应后得到1.12g固体丁。
根据以上实验现象或数据,该同学得出的结论正确的是
A.根据①可推出铝灰中一定含有![]() B.根据②可推出铝灰中一定含有KCl
B.根据②可推出铝灰中一定含有KCl
C.根据③可推出铝灰中一定含有![]() D.根据④可推出固体丙中一定不含MgO
D.根据④可推出固体丙中一定不含MgO
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应。向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如下图。回答下列问题:

(1)写出OA段和BC段反应的离子方程式:
OA:___________ ; BC:_____________;
(2)原Mg-Al合金的质量是_____________。
(3)原HCl溶液的物质的量浓度是________________。
(4)所加NaOH溶液的物质的量浓度是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】当实验出现某种现象时,即可判定该步实验操作已完成。下列实验中出现结束该步操作的现象正确的是
A.“镀锌铁皮锌镀层厚度的测定”:铁皮在稀硫酸溶液中不再产生气泡
B.“食醋总酸含量的测定”:滴入NaOH标准溶液,锥形瓶内溶液恰好呈浅红色
C.“乙酸乙酯碱性条件下水解”:NaOH溶液上层的油层消失
D.“硫酸亚铁铵的制备”:蒸发![]() 和
和![]() 混合溶液,出现大量晶体
混合溶液,出现大量晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,![]() 的
的![]() 和
和![]() 的
的![]() 两种酸溶液,起始时的体积均为
两种酸溶液,起始时的体积均为![]() ,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是
,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是
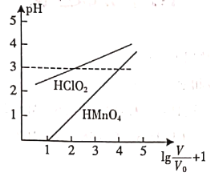
A.在![]() 时,
时,![]() 溶液满足
溶液满足![]()
B.当稀释至pH均为3时,溶液中![]()
C.稀释前分别用![]() 的NaOH溶液中和,消耗的NaOH溶液体积:
的NaOH溶液中和,消耗的NaOH溶液体积:![]()
D.常温下,浓度均为![]() 的
的![]() 和
和![]() 溶液的
溶液的![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积可变的恒温密闭容器中按![]() 充入
充入![]() 和
和![]() ,发生反应:
,发生反应:![]()
![]() ,在t1时刻达到平衡状态I;在t2时刻向容器中充入一定量的
,在t1时刻达到平衡状态I;在t2时刻向容器中充入一定量的![]() ,t3时刻达到平衡状态Ⅱ。下列说法正确的是
,t3时刻达到平衡状态Ⅱ。下列说法正确的是
A.t1时刻达到平衡时,v(N2)=3v(H2)
B.t1时刻达到平衡时反应放出的热量小于Q kJ
C.达到平衡时,![]() 的体积分数:
的体积分数:![]()
D.![]() 过程中,v(逆)随时间变化如图所示
过程中,v(逆)随时间变化如图所示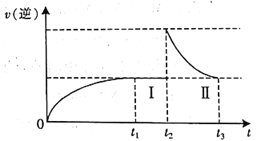
查看答案和解析>>
科目: 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
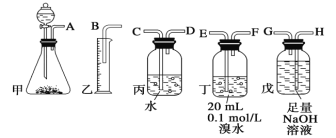
(1)电石制备乙炔气体的化学方程式____________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是____________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体通常用_______________;
(4)若在标准状况下溴水与乙炔完全反应生成C2H2Br4,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为____________;
(5)若没有装置戊,测定结果将会______(填“偏高”、“偏低”或“不变”) ,理由是(方程式表示)____;
(6)干燥乙炔可用_____________(填选项);
A. 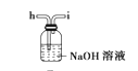
B.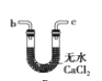
C.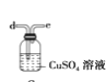
D.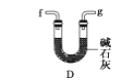
(7)为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:纯净乙炔气 ![]() 混合液
混合液 ![]() 有机混合物Ⅰ
有机混合物Ⅰ ![]() 混合液
混合液 ![]() 有机混合物Ⅱ
有机混合物Ⅱ
①操作b的名称是________;
②有机混合物Ⅰ可能含有的物质是________(写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com