
科目: 来源: 题型:
【题目】下列反应属于非氧化还原反应的是( )
A. Fe2O3+3CO![]() 2Fe+3CO2 B. NH4NO3
2Fe+3CO2 B. NH4NO3![]() N2O↑+2H2O
N2O↑+2H2O
C. 2NaHCO3![]() Na2CO3+CO2↑+H2O D. CuO+CO═Cu+CO2
Na2CO3+CO2↑+H2O D. CuO+CO═Cu+CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】将物质的量之比为1:3的氮气和氢气充入恒容密闭容器中,测定不同温度、压强下平衡混合物中氨的物质的量分数,结果如图所示。下列说法不正确的是( )
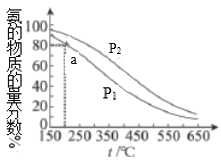
A.![]()
B.该反应![]()
C.![]() 点,
点,![]() 的转化率为
的转化率为![]()
D.合成氨工业实现了人工固氮
查看答案和解析>>
科目: 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与盐酸完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中滴加KSCN溶液不变血红色。请计算并回答下列问题:
(1)该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为_____________。
(2)该磁黄铁矿FexS中,x=_________________。
查看答案和解析>>
科目: 来源: 题型:
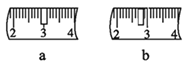
【题目】配制一定物质的量浓度的溶液,几个关键实验步骤和操作如图:

(1)现需要94 mL 0.10 mol·L-1 Na2CO3溶液,进行现场配制。上述实验步骤A~F正确的实验次序为_______________________(填字母)。步骤E中将一玻璃仪器上下颠倒数次,写出该仪器的名称_________________。
(2)步骤C通常称为溶解,步骤A通常称为_________。
(3)用Na2CO3·10H2O来配制该溶液,托盘天平称取样品,游码需要打在图示________(填a或b)位置,若称量前晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_______(填“大”或“小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作能达成实验目的且涉及到氧化还原反应的是( )
选项 | 实验目的 | 实验操作 |
A | 除去 | 先后通过盛有酸性 |
B | 除去 | 加入过量 |
C | 检验溶液中含有 | 加入 |
D | 检验稀硫酸催化淀粉水解的产物为葡萄糖 | 向水解后的溶液中直接加入新制 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析可得:
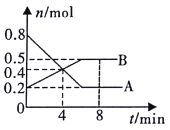
(1)该反应的化学方程式为____。
(2)若降低温度,则该反应的正反应速率______,逆反应速率______(均填“加快”“减慢”或“不变”)。
(3)第4min时,正、逆反应速率的大小关系为:v(正)______v(逆)(填“>”、“<”或“=”)。
(4)反应至4min时,A的转化率______。
(5)能判断该反应在一定温度下达到化学平衡状态的依据是_____(填字母代号)。
A.v(A)=2v(B)
B.容器内压强不再发生变化
C.容器内气体密度不再发生变化
D.B的体积分数不再发生变化
E.容器内气体原子总数不再发生变化
F.相同时间内消耗2nmol的A的同时生成nmol的B
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.为探究硫酸铜晶体(CuSO4·xH2O)受热分解后所得产物,设计实验装置如图所示,部分实验现象为:A中蓝色晶体逐渐变成白色粉末,继续加热最终变成黑色;B中产生白色沉淀;D中溶液变成红色。(洗气瓶中试剂均足量)

(1)分析推测该硫酸铜晶体最终分解产物可能有_______________________________。
(2)D中的反应分两步进行,写出第一步反应的离子方程式_____________________。
II.测定硫酸铜晶体(CuSO4·xH2O)中结晶水x的值,实验装置和过程如下:取硫酸铜晶体7.23 g置于硬质试管中,先通N2排除体系内空气,酒精喷灯高温加热充分,待A中蓝色晶体最终变成黑色,停止加热,再次鼓入N2至装置冷却到室温。(洗气瓶中试剂均足量)
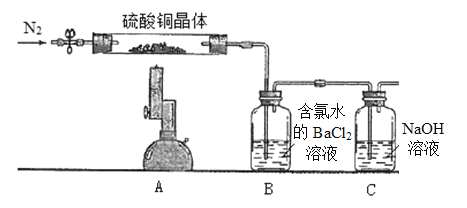
(1)取B中白色沉淀经过滤洗涤干燥称量得固体6.99 g,经计算可得CuSO4·xH2O中x=__________,再次鼓入N2的目的是____________________。
(2)某同学提出,要测定晶体中结晶水x的值,也可将B装置用装有浓硫酸的洗气瓶替换,最终测浓硫酸增重即可计算得到结果,评价该同学的方案是否可行?(如果不可行,请说明理由)_____________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究某难溶性盐X(仅含三种常见元素)的组成,设计并完成以下实验(流程中部分物质已略去):
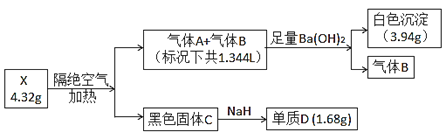
已知:气体A和气体B所含元素相同,都是无色无味气体,固体C为纯净物且具有磁性,单质D是目前建筑行业应用最广泛的金属。根据上述信息,回答下列问题:
(1)盐X的化学式为________________。
(2)无水条件下,少量NaH就能与固体C反应并放出大量的热,写出该反应的化学方程式___________________。
(3)将产生的气体A全部被100 mL 0.35 mol·L-1氢氧化钠溶液充分吸收,反应的总离子方程式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10﹣5 |
HClO | HClO | 3.0×10﹣8 |
H2CO3 | H2CO3 HCO3﹣ | K1=4.4×10﹣7 K2=5.61×10﹣11 |
H3PO4 | H3PO4 H2PO4﹣ HPO42﹣ | K1=7.1×10﹣3 K2=6.3×10﹣8 K3=4.2×10﹣13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3﹣、H3PO4、H2PO4﹣、HPO42﹣都看作是酸,则它们酸性最强的是_______(填化学式,下同),最弱的是________。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为_______。
(3)求出该温度下,0.10molL﹣
(4)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是____。
A.c(H+) B.c(H+)c(CH3COO﹣) C.c(H+)c(OH﹣) D.c(OH﹣)/c(H+)
(5)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1_____V2( 填“>”、“<”或“=”)。
(6)下列四种离子结合H+能力最强的是_______。
A.HCO3﹣ B.CO32﹣ C.ClO﹣ D.CH3COO﹣
(7)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是(_________)
A.Va>10Vb B.Va<10Vb C.Vb <10 Va D.Vb>10Va
查看答案和解析>>
科目: 来源: 题型:
【题目】化学基本概念是学习化学的基石,请正确回答下列问题。
(1)今有7种物质:①液态氯化氢 ②乙醇 ③熔融的KNO3 ④铜线 ⑤NaCl晶体 ⑥小苏打溶液 ⑦氨水。属于电解质的是___________,属于非电解质的是_____________。将①加入到⑦中,⑦的导电能力_______(填“增强”、“减弱”或“基本不变”)。
(2)漂白粉中加入盐酸,可产生氯气,化学方程式为:Ca(ClO)2+4HCl = CaCl2 +2Cl2+2H2O。用双线桥法表示该反应中电子转移的方向和数目_________,当有0.1 mol电子发生转移时,生成氯气的体积为_______L(标况下),被氧化的HCl为______mol。
(3)“四种基本反应类型与氧化还原反应的关系”如图所示:
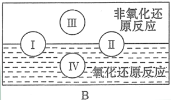
其中Ⅰ为化合反应,Ⅳ是_________反应。现有以下反应模型:单质A + 氧化物B=单质C + 氧化物D(A、B、C、D均为中学阶段常见物质,反应条件已略去),写出符合上述反应模型的化学反应方程式。
①若A为金属单质,B为非金属氧化物:_________________________。
②若A和C均为固体非金属单质:_______________________________。
(4)浓硫酸有强氧化性,常温下,向碳素钢(仅含铁、碳元素的合金)中加入少量浓硫酸,无明显现象,原因是:____________________,加热后,可能产生的气体有___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com