
科目: 来源: 题型:
【题目】t℃时,A的溶解度是Sg·100g-1,其饱和溶液密度为dg·cm-3、物质的量浓度为cmol·L-1。溶液的质量分数为w,A的摩尔质量为Mg·mol-1,实验测得向一定量含A的溶液中加入mg无水A或蒸发掉ng水后恢复到t℃,均为饱和溶液,下列关系式正确的是( )
A.S=![]()
B.c=![]()
C.S=![]()
D.c%=![]() 100%
100%
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物F是合成一种增强记忆力药物的重要中间体,其合成路线如下:
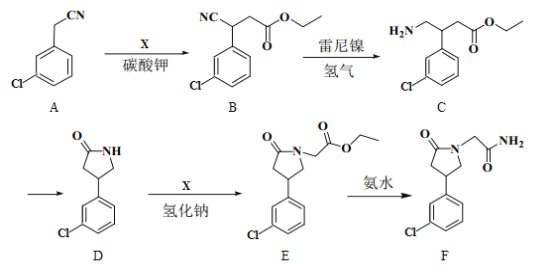
(1)E中的含氧官能团名称为__________。(写一种)
(2)A→B的反应类型为__________。
(3)写出同时满足下列条件的B的一种同分异构体的结构简式:__________。
①为α-氨基酸;②苯环上有4个取代基;③有6种不同化学环境的氢。
(4)C转为D生成的另一种产物的结构简式为__________。
(5)已知:R—Br→R—CN,请写出以苯甲醇(![]() )和
)和![]() 为原料制备有机物X
为原料制备有机物X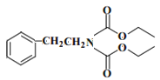 (结构如图)的合成路线流程图__________________(无机试剂任用,合成路线流程图示例见本题题干)。
(结构如图)的合成路线流程图__________________(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,硫酸既表现了氧化性又表现了酸性的是( )
A.2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
B.2H2SO4(浓)+C![]() CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑
C.H2SO4(浓)+NaNO3![]() NaHSO4+HNO3↑
NaHSO4+HNO3↑
D.H2SO4+Na2SO3===Na2SO4+H2O+SO2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】废铅蓄电池的回收中产生大量的铅膏,回收利用铅膏能有效减少铅污染,充分利用铅资源。
(1)铅膏制备PbO。铅膏经过预处理后(主要成分为PbSO4)加入Na2CO3溶液,使之转化为PbCO3,然后充分灼烧得到PbO。
①PbCO3分解产生aPbCO3bPbO中间产物。PbCO3和PbSO4加热升温过程中固体的质量变化见图1。PbCO3在300 ℃时分解的产物为_____________。
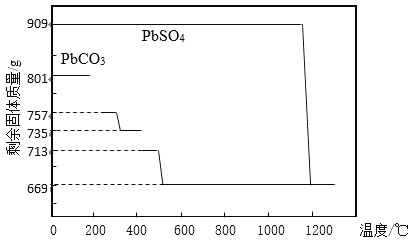
②工业上用PbCO3热分解制备的PbO而不直接热分解PbSO4制备的PbO的原因是_____________。
(2)沉淀除铅。铅膏经过转化后得到含铅的Na2SO4废液,需要进一步除去废水中的铅。
①常温下,该废液中![]() 浓度为0.01 mol·L1,则该废液中Pb2+浓度最大为_____________。[Ksp(PbSO4)=1.8×108]
浓度为0.01 mol·L1,则该废液中Pb2+浓度最大为_____________。[Ksp(PbSO4)=1.8×108]
②随温度升高和![]() 浓度增大废液中Pb2+浓度显著增大,所以工业通常采用向废液中加入Na2CO3、NaHCO3或NaOH等碱性沉淀剂产生Pb(OH)2沉淀除铅。废液随着pH的变化生成Pb(OH)2的质量如图2。向含铅废液中投放NaHCO3发生的离子方程式为_____________。在实际生产中采用NaHCO3或Na2CO3沉铅,不采用NaOH的原因是_____________。
浓度增大废液中Pb2+浓度显著增大,所以工业通常采用向废液中加入Na2CO3、NaHCO3或NaOH等碱性沉淀剂产生Pb(OH)2沉淀除铅。废液随着pH的变化生成Pb(OH)2的质量如图2。向含铅废液中投放NaHCO3发生的离子方程式为_____________。在实际生产中采用NaHCO3或Na2CO3沉铅,不采用NaOH的原因是_____________。
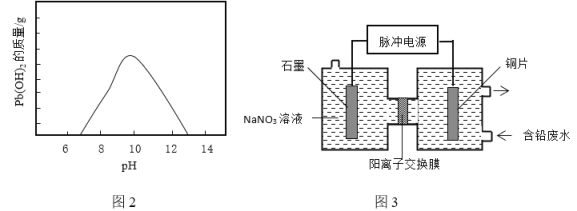
(3)电化学除铅。利用脉冲电源(间歇性通入电流)电解法转化废液中的Pb2+实现铅资源化利用,可以提高除铅效率(除铅效率与Pb2+浓度有关),其原理示意图3。
①写出阳极的电极反应式:__________。
②采用脉冲电解比普通电源电解的优点是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组按图1所示的装置探究铁的吸氧腐蚀。
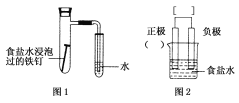
(1)图2是图1所示装置的示意图,在图2的小括号内填写正极材料的化学式_________;在方括号内用箭头表示出电子流动的方向___________。
(2)正极反应式为_____________________,负极反应式为__________________。
(3)按图1装置实验,约8 min时才看到导管中液柱上升,下列措施可以更快更清晰地观察到液柱上升的是________。
a.用纯氧气代替具支试管内的空气
b.将食盐水浸泡过的铁钉表面撒上铁粉和碳粉的混合物
c.用毛细尖嘴管代替玻璃导管,并向试管的水中滴加少量红墨水
查看答案和解析>>
科目: 来源: 题型:
【题目】每次取20 g海水,严格按照过滤、蒸发、冷却、称量、计算的实验步骤规范操作,连续实验三次,平均得固态盐a g。该海水中含氯化钠的质量分数是( )
A.大于5a%
B.小于5a%
C.等于5a%
D.无法判断
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿是工业冶炼铜的原料,主要成分为CuFeS2。试回答下列问题:
(1)基态Cu原子的核外电子排布式为________;Cu、Zn的第二电离能大小I2(Cu)________(填“>”“<”或“=”)I2(Zn)。
(2)SO2分子中分子空间构型为________;与SO2互为等电子体的阴离子有________(写一种)。
(3)[Cr(H2O)4Br2]Br·2H2O中心离子配位数为_______
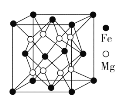
(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。晶胞距离Mg原子最近Mg数目为____________
查看答案和解析>>
科目: 来源: 题型:
【题目】铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:Pb(s)+PbO2(s)+2H2SO4(aq) ![]() 2PbSO4(s)+2H2O(l)。根据上述情况判断:
2PbSO4(s)+2H2O(l)。根据上述情况判断:
(1)放电时,电解质溶液的pH________(填“增大”“减小”或“不变”)。
(2)放电时,电解质溶液中阴离子移向_____极,电子从_____极流向____极。
(3)写出负极的电极方程式:_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com