
科目: 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大。①A元素组成的单质是相同条件下密度最小的物质;②B元素原子的最外层电子数是其内层电子总数的2倍;③D原子的电子层数与最外层电子数之比为3:1;④E元素的最外层电子数是电子层数的2倍;⑤C与E同主族。请回答下列问题:
(1)B元素在周期表中的位置是:______________
(2)写出化合物D2C2的电子式____________;该化合物中所含化学键类型为____________
(3)化合物A2C和A2E中,沸点较高的是______________(填化学式)
(4)化合物EC2常温下呈气态,将其通入Ba(NO3)2溶液中,有白色沉淀和NO气体放出,该反应的离子方程式为_______________
(5)元素A、B、C按原子个数比2:1:1组成的化合物是常见的室内装修污染物,该物质的分子空间构型为______________;该化合物中B原子的杂化轨道类型为______________
查看答案和解析>>
科目: 来源: 题型:
【题目】含氯化合物在工业上有着广泛的用途。
Ⅰ.高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室可用NaClO4与NH4Cl制取。
(部分物质溶解度如图1、图2),流程如图3:
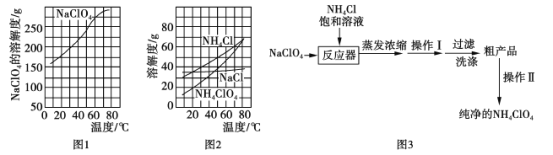
(1)反应器中发生反应的化学方程式为_______。
(2)上述流程中操作Ⅰ为__________,操作Ⅱ为__________。
(3)上述流程中采取的最佳过滤方式应为__________(填字母代号)
A.升温至80℃以上趁热过滤
B.降温至0℃左右趁冷过滤
C.0℃-80℃间任一温度过滤
Ⅱ.一氯化碘(沸点97.4℃)是一种红棕色易挥发的液体,不溶于水,溶于乙醇和乙酸。某学习小组拟用干燥、纯净的氯气与碘反应制备一氯化碘,其装置如下:(已知碘与氯气的反应为放热反应)
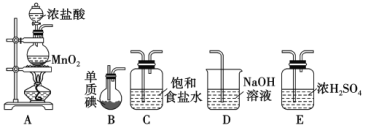
(1)各装置连接顺序为A→___________→___________→___________→___________
(2)B装置烧瓶需放在冷水中,其目的是___________,D装置的作用是________________。
(3)将B装置得到的液态产物进一步提纯可得到较纯净的ICl,则提纯采取的操作名称是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知 SO32ˉ+I2+H2O= SO42ˉ+2Iˉ+2H+,将 0.09molCl2通入 100mL 含 a molNaI与 a mol Na2SO4的混合溶液中,有 0.25a mol的 NaI 被氧化(不考虑 Cl2 与 I2 之间的反应),则下列说法正确的是
A.物质的还原性 Iˉ >SO32ˉ
B.NaI 与 Na2SO3 的物质的量浓度为 0.08mol/L
C.通入 0.09molCl2 发生反应的离子方程式为:8SO32ˉ+2Iˉ+9Cl2+8H2O=8SO42ˉ+I2+16H++18Clˉ
D.若再通入0.07molCl2,恰好能将 NaI与 Na2SO3 完全氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。测得v正(SO2)随反应时间(t)的变化如图所示。下列有关说法正确的是( )
2SO3(g) ΔH<0。测得v正(SO2)随反应时间(t)的变化如图所示。下列有关说法正确的是( )
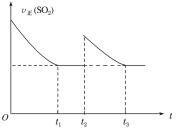
A.t2时改变的条件是:只加入一定量的SO2
B.t1时平衡常数K1大于t3时平衡常数K2
C.t1时平衡混合气体的平均相对分子质量大于t3时平衡混合气体的平均相对分子质量
D.t1时平衡混合气体中SO3的体积分数等于t3时平衡混合气体中SO3的体积分数
查看答案和解析>>
科目: 来源: 题型:
【题目】X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质X的晶体类型为___________,其中X原子的配位数为___________。
(2)元素Y基态原子的核外电子排布式为_____________,同周期元素中,第一电离能最大的是___________(写元素符号)。
(3)X与Y形成的一种化合物的立方晶胞如图所示。
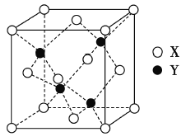
①该化合物的化学式为____________________,已知晶胞参数a=0.542nm,此晶体的密度为____________ g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究NO与铜粉的反应,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2。
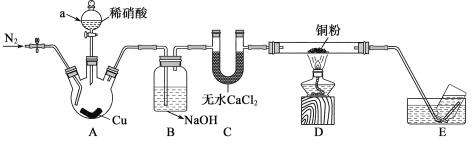
回答下列问题:
(1)通入N2的作用:_____________,仪器A的名称_____________。
(2)A中发生反应的离子方程式:_______________
(3)B中NaOH的作用__________________________。
(4)D中有__________________________现象,即可证明NO与Cu反应。
(5)NO可被Ce4+氧化,制得NH4NO3产品,流程如下(Ce为铈元素)。
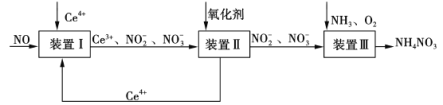
①装置Ⅰ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,写出生成等物质的量的NO3-和NO2-的离子方程式:________________。
②已知进入装置Ⅲ溶液中NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,至少需通入标况下的O2________L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法不正确的是
A.4.6gNa 与含 0.1molHCl 的稀盐酸充分反应,转移电子数目为 0.2 NA
B.质量为 3.0g 的 15N2 和 C18O 混合物中含有中子数为 1.6NA
C.常温常压下,1.12L 的 CO2 和 SO2 混合气体中,含有氧原子的数目小于 0.1NA
D.在 1L相同浓度的硫酸钾和硫酸铁混合液中K+浓度为 0.2 mol·Lˉ1,则溶液中 SO42—的数目为0.3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列几种类推结论符合事实的是
A.氯水可以将 Fe2+氧化至 Fe3+,则碘水也可以将 Fe2+氧化至 Fe3+
B.Fe3O4 可改写为 FeO·Fe2O3,则 Fe3Cl8 也可改写为 FeCl2·2FeCl3
C.Cl2+H2OHCl+HClO 是氧化还原反应,则 ICl+H2OHCl+HIO 也是氧化还原反应
D.CO2 溶于 H2O 生成 H2CO3,则 SiO2 也能溶于 H2O 生成 H2SiO3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是
A.次氯酸钠溶液中通入少量的二氧化硫:SO2+3ClOˉ+H2O=SO42ˉ+Clˉ+2HClO
B.碳酸氢钠溶液与足量盐酸反应:CO32ˉ+2H+=CO2↑+H2O
C.稀硫酸和氢氧化钡溶液反应:Ba2++OHˉ+H++SO42ˉ= BaSO4↓+H2O
D.锌和浓硫酸反应:Zn+2H+=H2↑+Zn2+
查看答案和解析>>
科目: 来源: 题型:
【题目】—定条件下,向密闭容器中充入一定量的气体X,发生反应3X(g)![]() Y(g)+xZ(g),一段时间后反应达到平衡。12min时,将容器体积压缩至原来的一半,一段时间后反应再次达到平衡。反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是( )
Y(g)+xZ(g),一段时间后反应达到平衡。12min时,将容器体积压缩至原来的一半,一段时间后反应再次达到平衡。反应中各时刻X物质的浓度如下表所示。下列说法中不正确的是( )
反应时间(min) | 0 | 5 | 12 | 17 | 20 |
X的浓度(mol·L-1) | 1.0 | 0.4 | 0.4 | 0.7 | 0.7 |
A.x=1
B.5min时该反应处于化学平衡状态
C.从反应开始到18min时,X的转化率为30%
D.05min内,该反应的平均速率为v(X)=0.12mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com