
科目: 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质和条件已略去)。A、B、E、G、H、J常温下为气体,A为黄绿色,J为红棕色,B能使湿润的红色石蕊试纸变蓝,E是空气中含量最多的气体,C工业上用于制取漂白粉,K为一种红色金属单质,I是常见的无色液体。
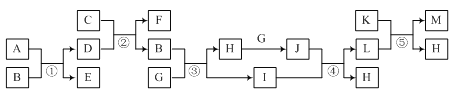
(1)E的化学式为___。
(2)反应②的化学方程式为___。
(3)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:___。
(4)反应⑤的离子方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究SO2的化学性质,设计了如下实验装置。
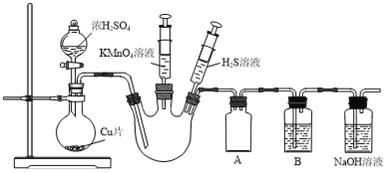
(1)该装置设计中存在的问题是___________________。
(2)装置A的作用是___________________。
(3)①当三颈烧瓶中充满SO2气体,证明SO2具有氧化性的实验操作及现象是___________________。
②若要证明SO2具有漂白性,可在洗气瓶B中加入___________________溶液。
(4)NaOH溶液用于吸收尾气中的SO2,由于空气氧化,溶液中可能会存在SO![]() ,检验溶液中是否存在SO
,检验溶液中是否存在SO![]() 的实验方法是___________________。
的实验方法是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)A、B、C为同一短周期金属元素。依据下表数据分析,A、B、C三种元素的离子半径由大到小的顺序是_____。(用离子符号表示)
电离能/kJmol-1 | I1 | I2 | I3 | I4 |
A | 500 | 4600 | 6900 | 9500 |
B | 740 | 1500 | 7700 | 10500 |
C | 580 | 1800 | 2700 | 11600 |
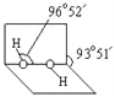
(2)已知H2O2分子的空间结构如图所示,H2O2分子中氧原子采取____________杂化;H2O2分子是______(填“极性分子”或“非极性分子”)。
(3)R是第4周期元素中未成对电子数最多的原子。R3+在溶液中存在如下转化:
R3+![]() R(OH)3
R(OH)3![]() [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为_____。
②[R(OH)4]-中存在的化学键是_____;1mol[R(OH)4]-离子中含有σ键的数目为_______mol。
A.离子键 B.极性键 C.非极性键D .配位键
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,反应![]() +H2O
+H2O![]() H2CO3+OH的平衡常数K=2.2×108。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
H2CO3+OH的平衡常数K=2.2×108。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.2mol·L1氨水:c(NH3·H2O)>c(NH4+)>c(OH)>c(H+)
B.0.2mol·L1NH4HCO3溶液(pH>7):c(NH4+)>c(HCO3-)>c(H2CO3)>c(NH3·H2O)
C.0.2mol·L1氨水和0.2mol·L1NH4HCO3溶液等体积混合:c(NH4+)+c(NH3·H2O)=c(H2CO3)+c(HCO3-)+c(CO32-)
D.0.6mol·L1氨水和0.2mol·L1NH4HCO3溶液等体积混合:c(NH3·H2O)+c(CO32-)+c(OH)=0.3mol·L1+c(H2CO3)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述不正确的是( )
A.50mL12mol·L-1的浓盐酸与足量MnO2共热,制得Cl2的分子数目小于0.15NA
B.10g46%乙醇水溶液中所含氧原子数为0.4NA
C.1L1mol/LNa2CO3溶液中,阴离子总数小于NA
D.浓硝酸热分解生成NO2、N2O4共23g,转移电子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:
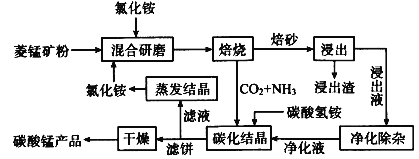
已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+)=0.1molL -1形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为___。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②__将Al3+、Fe3+变为沉淀除去;③加入NH4F将__离子沉淀除去。写出反应①的离子方程式为___;
(3)碳化结晶时,反应的离子方程式为___。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是__。流程中能循环利用的物质除了氯化铵之外还有__。
(5)测定碳酸锰产品的纯度。
称取0.5000g碳酸锰产品于锥形瓶中,加25.00mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为0.2000mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+=Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
滴定次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
则产品的纯度=__,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度__(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物F是一种临床常用的基本药物,有广泛的用途,其合成路线如下:
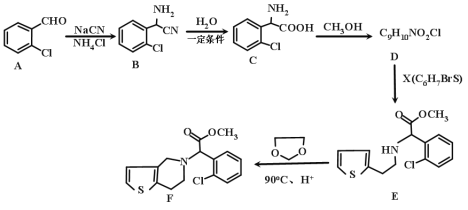
(1)A的化学名称是________,B的分子式是_____________。
(2)C中含氧官能团的名称为________。)
(3)请写出 C→D 的化学方程式为___________,其反应类型是________。
(4)G是C的同系物,且少一个碳原子,则G的结构有_____种。
(5)X的结构简式为___________。
(6)已知: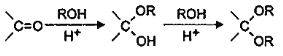 ,则由乙烯、甲醛为有机原料制备化合物
,则由乙烯、甲醛为有机原料制备化合物![]() ,请写出合成路线________(无机试剂任选)
,请写出合成路线________(无机试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物在工业生产和日常生活中有着广泛的应用。
某化学小组拟采用如下装置(夹持和加热仪器已略去)来测定铜的相对原子质量,同时检验氯气的氧化性。
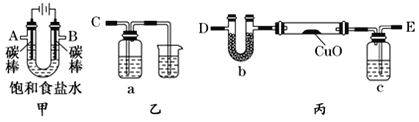
(1)装置甲中发生反应的化学方程式是:__________。
(2)已知装置甲中B处有黄绿色的气体产生,且 B连C ;则A连________(填写连接的字母)。
(3)乙装置的a瓶中溶液可以是________(填标号)
A 酸性KMnO4溶液 B CCl4溶液 C 滴加有KSCN溶液的FeCl2溶液 D 饱和食盐水
(4)在检查装置气密性后,加热丙装置硬质玻璃管里的CuO粉末前,还需要进行的操作为________。
(5)准确称量m g CuO进行实验,当CuO完全反应后测出b中增重n g。则Cu的相对原子质量为____________(只要求列出算式)。该实验方案的装置有不合理之处,若不加以改进会导致测定结果__________ (填“偏大”、“偏小”或“不变”)。
(6)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧CuCl2样品时,铜的焰色为__________(填标号)。
A 绿色 B 红色 C 紫色 D 黄色
(7)向CuCl2溶液中通人H2S气体,可产生CuS沉淀,反应离子方程式为:Cu2+ + H2S=CuS(s) + 2H+,则该反应的平衡常数K=_________(保留一位小数)。已知:CuS溶度积Ksp=1.0×10-36,H2S电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。
查看答案和解析>>
科目: 来源: 题型:
【题目】S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法中错误的是( )

A.S2Cl2为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔、沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O===SO2↑+3S↓+4HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com