
科目: 来源: 题型:
【题目】下列物质有如下转化关系![]() 有的生成物未列出
有的生成物未列出![]() ,其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
,其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
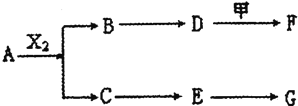
A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素.则:
(1)X在周期表中的位置是 ______ ,R、X、T的原子半径从小到大的顺序为 ______ ![]() 用元素符号表示
用元素符号表示![]() ;
;
(2)A和G等物质的量反应产物的水溶液显 ______ 性,其原因用离子方程式表示为 ______ ;
(3)A和X2反应的化学方程式为 ______ ;
(4)pH均为12的D溶液和F溶液中,水电离出的c(OH-)之比为 ______ ;
(5)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和CO反应转化为两种空气的成分,当反应转移1 mol电子时,生成的气体在标准状况下的总体积为 ______ L。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族。回答下列问题:
(1)X的价电子排布式为____________,Y的电子排布图为___________;
(2)ZX2的分子式是________________,VSEPR模型名称为________________。YX2的电子式是______________,中心原子发生了________杂化。
(3)Y与Z形成的化合物的分子式是_______________。Y的氢化物中分子构型为正四面体的是_________(填名称),键角为______________,中心原子的杂化形式为_________。
(4)X的氢化物的沸点比同主族其他元素形成的氢化物沸点高,原因是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Q、W、X、Y、Z五种短周期元素在周期表中的相对位置如下图所示,其中W的单质是一种重要半导体材料。
|
|
| Y |
|
Q | W | X |
| Z |
请按要求回答下列问题:
(1)Y的原子结构示意图为________;举一例说明Z的非金属性比X的非金属性强的事实:________。
(2)W、X、Y的原子半径由大到小依次![]() 填元素符号
填元素符号![]() ________:W与Z形成的化合物电子式为________。
________:W与Z形成的化合物电子式为________。
(3)将Z的单质通入到含等物质的量FeBr2溶液中充分反应的离子方程式为________。
(4)已知: 2Na(s)+![]() Y2(g)=Na2Y(s)H=-414kJ/mol;2Na(s)+Y2(g)=Na2Y2(s)H=-511kJ/mol;则Na2Y(s)转变为Na2Y2(s)的反应一定条件下能自发进行的理由是________。将0.2mol Na2Y2加入到100mL1mol/L的QZ3中,充分反应的化学方程式为________。
Y2(g)=Na2Y(s)H=-414kJ/mol;2Na(s)+Y2(g)=Na2Y2(s)H=-511kJ/mol;则Na2Y(s)转变为Na2Y2(s)的反应一定条件下能自发进行的理由是________。将0.2mol Na2Y2加入到100mL1mol/L的QZ3中,充分反应的化学方程式为________。
(5)R与W同周期,已知:在T℃时Ksp[R(OH)2]的值为4.0×10-12,则R(OH)2饱和溶液中c(OH-)=________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )
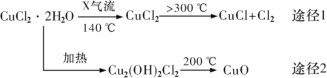
A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2CuCl+4H++SO42—=2Cu2++2Cl—+SO2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】U、V、W、X、Y、Z 是原子序数依次增大的六种常见元素。Y 的单质在 W2 中 燃烧的产物可使品红溶液褪色 。 Z 和 W元素形成的化合物 Z3W4 具有磁性 。 U 的单质在 W2中燃烧可生成 UW 和 UW2 两种气体 。 X 的单质是一种金属,与冷水反应缓慢、与沸水反应迅速。
请回答下列问题:
(l)V的单质的分子式为____________ 。
(2)Z元素在周期表中的位置是____________。
(3)U、V、W形成的10电子氢化物中,沸点最高的是_________(填化学式,下同);V、W 的简单氢化物分子结合H+能力较强的是_________。
(4)X和Y元素形成的化合物的电子式为___________。
(5)Y的最高价氧化物对应的水化物与X单质反应的离子方程式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。
请回答下列问题:
(1)X、Y的元素符号依次是 _________、_________。
(2)XZ2与YZ2分子的立体构型分别是______________和_______________,相同条件下两者在水中的溶解度较大的是____________(写分子式)。
(3)Q的元素名称是_________,它在元素周期表中的位置是_________________,它的核外电子排布式为____________________,在形成化合物时它的最高化合价为___________。
(4)Y、Z、E三种元素原子的第一电离能由大到小的顺序是____________。(用元素符号表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应的离子方程式书写正确的是( )
A.氯化铝溶液与过量氨水反应:3NH3H2O+Al3+=Al(OH)3↓+3NH4+
B.向氢氧化钠溶液中通入过量的CO2气体:CO2+2OH-=CO32-+H2O
C.FeCl3溶液与Cu粉反应:Cu+Fe3+=Cu2++Fe2+
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是( )

A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
B.试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象
C.实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率
D.试管b中Na2CO3的作用是除去随乙酸乙酯蒸出的少量乙酸和乙醇,降低乙酸乙酯在溶液中的溶解度
查看答案和解析>>
科目: 来源: 题型:
【题目】已知钼(Mo)的晶胞如图所示,钼原子半径为a pm,相对原子质量为M,以NA表示阿伏加德罗常数的值。
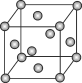
(1)钼晶体的堆积方式为_______________,晶体中粒子的配位数为________________。
(2)构成钼晶体的粒子是________(填“原子”,“分子”或“离子”),晶胞中所含的该种粒子数为___________。
(3)金属钼的密度为______________g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com