
科目: 来源: 题型:
【题目】新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图所示。下列说法错误的是

A. 放电时电流从石墨电极流向锌电极
B. 充电时阳极反应式为:3I--2e-=I3-
C. 若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目: 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,其常见的化合物有钙钛矿、硫酸氧钛(TiOSO4)、钛酸(H2TiO3)、二氧化钛(TiO2)、四氯化钛(TiCl4)等,回答下列问题:
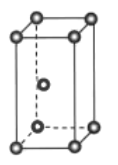
(1)基态钛原子的价层电子排布式为______,金属钛晶体的晶胞结构如图所示,其堆积方式名称为______。
(2)硫酸氧钛的阳离子为TiO2+,其阴离子的VSEPR模型名称为______。TiOSO4在水溶液中不稳定,易生成钛酸沉淀,该反应化学方程式为______。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图:
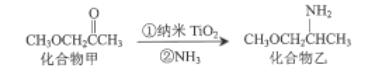
化合物乙种C、N、O元素的第一电离能由大到小的顺序为______。化合物甲的沸点低于化合物乙的沸点,主要原因是______。
(4)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,由此可知TiCl4为______晶体。将TiCl4加入盐酸中,经处理可得到一种配位数为6的绿色晶体TiCl36H2O,1mol该晶体恰好与含2molAgNO3的溶液反应得到白色沉淀,则该绿色晶体中配离子的化学式为______。
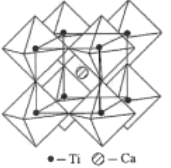
(5)钙钛矿的一种晶体结构如图所示。Ti位于立方晶胞的顶点,每个Ti被6个O包围成配位八面体,Ca位于立方晶胞的体心,与Ca距离最近的O有______个;若Ca与Ti的最近核间距为apm,阿伏伽德罗常数为NA,则此钙钛矿的密度为______gcm-3.(列出计算式即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
(1)N2O又称笑气,有轻微的麻醉作用,N2O在一定条件下可分解为N2、O2。回答下列问题:
已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJmol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJmol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJmol-1
则反应2N2O(g)=2N2(g)+O2(g) △H=_______ kJmol-1
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10molCO和8molNO发生反应,测得平衡时NO的体积分数与温度、压强的关系如下图

①已知T2>T1,则反应2NO(g)+2CO(g)![]() 2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有____(填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,此时容器的体积为4L,则用N2的浓度变化表示的平均反应速率v(N2)=____,该温度下用分压表示的平衡常数Kp= ___MPa-1(分压=总压×物质的量分数)。
④在D点,对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中____点。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。

①在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是____。
②当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
科目: 来源: 题型:
【题目】糖类、油脂、蛋白质都是和生命息息相关的物质,下列有关说法正确的是( )
A.葡萄糖和蔗糖是同系物,淀粉和纤维素是同分异构体
B.淀粉、纤维素、油脂、蛋白质都是高分子化合物,都能发生水解反应
C.用甘氨酸(![]() )和丙氨酸(
)和丙氨酸(![]() )缩合,最多可以生成4种二肽
)缩合,最多可以生成4种二肽
D.“春蚕到死丝方尽,蜡炬成灰泪始干”种的“丝”、“泪”分别是纤维素和油脂
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.1000mol/LBOH溶液滴定20mL 0.1000mol/L一元酸HA溶液,其滴定曲线如右图所示。下列说法正确的是

A. HA的电离平衡常数Ka为1×10-14
B. 滴定时应选择甲基橙作指示剂
C. 当滴入BOH溶液20 mL时,溶液中:c( B+)=c(A-) > c(OH- ) = c(H+)
D. 当滴入BOH溶液10 mL时,溶液中:c(A-)> c(B+)> c(H+)> c( OH- )
查看答案和解析>>
科目: 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值。下列说法正确的是
A.含有 NA 个氦原子的氦气在标准状况下的体积约为11.2 L
B.标准状况下,11.2 L由N2 与CO组成的混合气体含有的原子数目为NA
C.标准状况下,22.4 L的H2O中含有的水分子数为NA
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定碳酸氢钠中杂质氯元素(离子状态)的含量,先称取ag试样用蒸馏水溶解,再用足量稀硝酸酸化,配成100mL溶液,取出20mL注入锥形瓶中,然后用cmol·L-1AgNO3标准溶液滴定Cl-,K2CrO4溶液为指示剂。
已知:常温下Ksp(AgCl)=2×10-10,Ksp(Ag2CrO4)=1.12×10-12,Ag2CrO4为砖红色。
(1)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):___;
(2)当Cl-恰好沉淀完全即溶液中残余c(Cl-)=1.0×10-5mol·L-1,则此时溶液中的c(CrO![]() )为___mol·L-1。
)为___mol·L-1。
(3)滴定过程中,使用棕色滴定管的原因是___;
(4)当最后一滴AgNO3滴入,___停止滴定。
(5)若此时消耗了AgNO3标准溶液VmL,则碳酸氢钠样品中杂质氯元素的质量分数表达式为___。
(6)下列情况会造成实验测定结果偏低的是___。
a.盛放AgNO3溶液的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:甲、乙、丙、丁为常见化合物,A、B为单质,相互转化关系如图。其中甲是天然气的主要成分。回答下列问题:
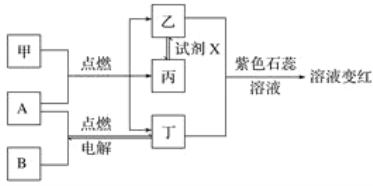
(1)丁物质的名称:______,丙物质的化学式:_________________________________________。
(2)检验化合物乙的化学方程式:___________________________________________________。
(3)试剂X可能的化学式:________、________(要求:所选物质类别不同)。
(4)通过分析表明:燃料充分燃烧的条件之一是______________________________。
(5)取变红溶液于试管中加热,观察到的现象有_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com