
科目: 来源: 题型:
【题目】莫尔盐[硫酸亚铁铵,(NH4)2Fe(SO4)26H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定,易溶于水,难溶于乙醇。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。

回答下列问题:
Ⅰ.制取莫尔盐
i.连接装置,检査装置气密性。将13.2g(NH4)2SO4晶体置于三颈烧瓶B中,将6.0g洁净铁屑加入锥形瓶中。
ii.打开仪器a瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。
iii.待大部分铁粉溶解后,打开K3、关闭K2,A中浅绿色溶液流入B。
iv.关闭活塞K2、K3,采用100℃水浴蒸发三颈烧瓶中水分,液面产生晶膜时,停止加热,冷却结晶、过滤、洗涤晶体。
(1)仪器a的名称是___。
(2)操作iii中浅绿色溶液会流入B的原因是___。
(3)操作iv中洗涤晶体所用试剂是___(填标号)。
A.水 B.无水乙醇 C.硫酸溶液
Ⅱ.为测定所得莫尔盐晶体纯度,取mg该样品配制成1L溶液,分别设计如下两个实验方案,请回答:
方案一:取20.00mL所配硫酸亚铁铵溶液用0.1000mol·L-1的酸性K2Cr2O7溶液进行滴定。重复三次。(已知:Cr2O72-还原产物为Cr3+)
(4)写出此反应的离子方程式___。
(5)滴定时必须选用的仪器是___。(填标号)
方案二:取20.00mL所配硫酸亚铁铵溶液进行如下实验。
![]()
(6)莫尔盐晶体纯度为___。(用含m、w的式子表示)
(7)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示。
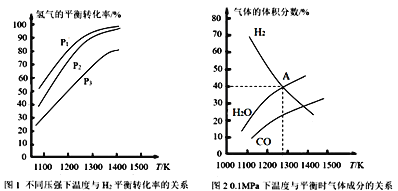
(1)该反应的平衡常数表达式为K=___。
(2)由图1可知,该反应ΔH__0(填“>”或“<”),p1、p2、p3由大到小的顺序为___。
(3)由图2可知,A点时H2的平衡转化率为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】锌银电池的负极为锌,正极为氧化银,电解质是KOH,电池反应为Zn+Ag2O+H2O=Zn(OH)2+2Ag。以锌银电池为电源,电解硫酸镍溶液冶炼纯镍,装置如图所示。下列说法正确的是( )
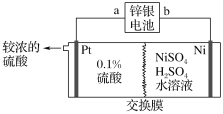
A.装置中使用阳离子交换膜
B.锌银电池a极反应式为Ag2O+H2O+2e-=2Ag+2OH-
C.左侧若加入稀盐酸,电解后得到比较浓的盐酸
D.若锌银电池溶解13 g锌,则镍极净增质量最多为5.9 g
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )
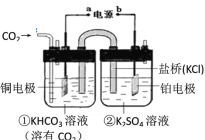
A.该过程是电能转化为化学能的过程
B.铜电极为阴极,发生还原反应
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,②池中溶液的pH一定下降
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)从绿色化学、环保的角度选择制取硫酸铜的原料________。
a.Cu b.CuO
c.CuS d.Cu(OH)2·CuSO4
(2)写出从硫酸铜溶液中得到硫酸铜晶体的操作:________、________、过滤、洗涤……
(3)如图球形管装置的作用:_________________________________________。
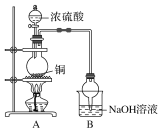
(4)反应后溶液中存在Cu2+,但浓硫酸有吸水性,不能通过溶液颜色来判断Cu2+的存在,请写出一种简便的方法验证Cu2+的存在:_________________________________________________________________。
(5)在实际反应中,由于条件控制不好,容易产生CuS和Cu2S固体。
已知:2CuS![]() Cu2S+S。取a g固体样品(只含CuS和Cu2S),加热后测得Cu2S固体质量为b g,求固体样品中CuS质量分数________:若Cu2S在高温下会分解为Cu,则测得CuS的质量分数________(偏大、偏小或不变)。
Cu2S+S。取a g固体样品(只含CuS和Cu2S),加热后测得Cu2S固体质量为b g,求固体样品中CuS质量分数________:若Cu2S在高温下会分解为Cu,则测得CuS的质量分数________(偏大、偏小或不变)。
(6)根据以上信息,说明Cu与浓硫酸反应需要控制哪些因素:________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图:
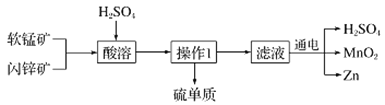
下列说法不正确的是( )
A.干电池是一种将化学能转变为电能的装置
B.酸溶时,ZnS作还原剂,每析出12.8gS沉淀,共转移0.8mol电子
C.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O═MnO2+4H+
D.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在容积为1L的密闭容器中,存在如下关系:xH2O(g) (H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是

A.x=3
B.该温度下,K=0.125 L2/mol2
C.从反应开始到平衡,该反应速率为v(H2O)=3mol·L-1·min-1
D.t1时刻,保持温度和容积不变,再充入1mol H2O(g),重新达到平衡时,![]() 将减小
将减小
查看答案和解析>>
科目: 来源: 题型:
【题目】反应![]()
![]() ,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,断开![]() 键的数目和生成
键的数目和生成![]() 键的数目相等
键的数目相等
D.容器内气体的浓度![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2=H++HO2-,Ka=2.4×10-12)。下列说法错误的是( )
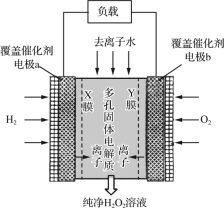
A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成1 mol H2O2电极上流过4 mol e-
D.b极上的电极反应为O2+H2O+2e-=HO2-+OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是
A.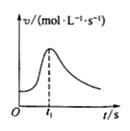 镁条与盐酸反应的化学反应速率随时间变化的曲线,说明t1时刻溶液的温度最高
镁条与盐酸反应的化学反应速率随时间变化的曲线,说明t1时刻溶液的温度最高
B.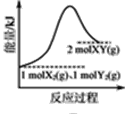 是1mol X2(g)、1mol Y2(g)反应生成2mol XY(g)的能量变化曲线,说明反应物所含化学键的键能总和小于生成物所含化学键的键能总和
是1mol X2(g)、1mol Y2(g)反应生成2mol XY(g)的能量变化曲线,说明反应物所含化学键的键能总和小于生成物所含化学键的键能总和
C. 是恒温密闭容器中发生CaCO3(s)CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,说明t1时刻改变的条件可能是缩小容器的体积
是恒温密闭容器中发生CaCO3(s)CaO(s)+CO2(g)反应时c(CO2)随反应时间变化的曲线,说明t1时刻改变的条件可能是缩小容器的体积
D. 是室温下,I2+I-I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)>K(T2)
是室温下,I2+I-I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)>K(T2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com