
科目: 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g) ![]() M2+(g)+O2(g)+CO2(g)
M2+(g)+O2(g)+CO2(g)
![]()
![]()
![]()
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B. ΔH2(MgCO3)=ΔH2(CaCO3)>0
C. ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D. 对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:

下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列根据实验操作、现象得出相应结论一定正确的是
选项 | 实验操作、现象 | 实验结论 |
A | 用pH计测定同浓度NaF溶液和CH3COONa溶液: pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
B | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应 FeCl3+3KSCN 的化学平衡逆向移动 |
C | 向盛有2ml0.1mol·L-1AgNO3的试管中滴加5滴0.1mol·L-1NaCl溶液,出现白色沉淀;再往试管中滴加5滴0.1mol·L-1KI溶液,出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
D | 将10mL2mol/L FeCl3的溶液与1mL1mol/LKI溶液混合充分反应后滴加KSCN,溶液颜色变红 | KI与FeCl3反应有可逆性 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH1 =-1266 kJ/mol,P4为正四面体结构,其中P-P键的键能为198 kJ/mol,Cl-Cl键的键能为243kJ/mol。下列说法正确的是( )
A.该反应在任何温度下都能自发进行
B.1mol P4和6mol Cl2具有的总能量比4mol PCl3具有的能量低
C.P-Cl键的键能为326kJ/mol
D.PCl3的电子式为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以纯铜屑为原料制取的流程如下:
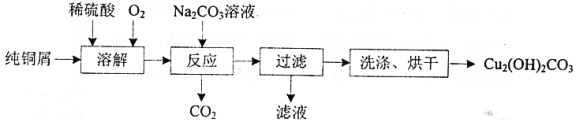
(1)“溶解”步骤反应的离子方程式为_______.温度宜控制在50℃左右,若高于50℃,溶液中O2溶解量减少、Cu的转化率降低,若低于50℃ ,_____
(2)“反应”步骤生成Cu2(OH)2CO3的化学方程式为_________。反应后溶液中铜元素残留量受pH和反应时间的影响如图所示:
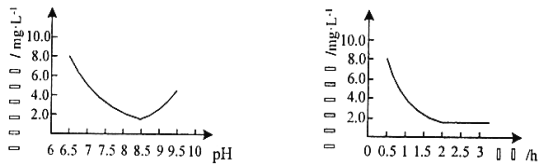
判断反应的最佳条件: pH为___、反应时间为____h。
(3)检验Cu2(OH)2CO3洗涤是否完全的方法是____________________
(4) Cu2(OH)2CO3也可以表示为CuCO3·Cu(OH)2。 查阅文献,上述反应条件下还可能生成少量CuCO3·Cu(OH)2。为测定产品的纯度[产品中Cu2(OH)2CO3的质量分数],取10.97g干燥样品,400℃左右加热,测得固体质量随时间变化关系如图所示。
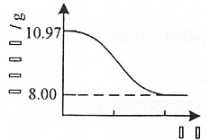
已知: 8.00g固体为黑色纯净物。
有关物质的摩尔质量如表:
物质 | CuCO3·Cu(OH)2 | CuCO3·2Cu(OH)2 | CuO |
摩尔质量/g·mol-1 | 222 | 320 | 80 |
请计算产品的纯度(写出计算过程,结果保留3位有效数字)。______
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数。下列说法正确的是( )
①在标准状况下,NA个SO3分子所占的体积为22.4L
②S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
③标准状祝下,22.4LNO和11.2LO2混合后气体的分子总数为1.5 NA
④1molAlCl3溶于1L的水中,所得溶液含有1NAAl3+
⑤在标准状况下,22.4LCl2与足量的氢氧化钾溶液反应转移的电子数为NA
⑥100mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是0.5NA
A.②⑤ B.①②④⑥ C.③⑤⑥ D.①②⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示镁条与盐酸反应的能量变化
B.图2表示H2SO4溶液中滴入BaCl2溶液后,溶液的导电性随BaCl2物质的量的变化
C.图3表示电解精炼铜时,溶液中Cu2+的物质的量浓度随转移电子物质的量的变化
D.图4表示其他条件一定,反应2SO2+O2![]() 2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
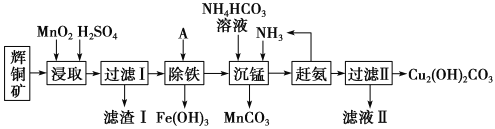
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=2.0×10-36
③Cu2S遇酸时会生成S
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_______,请用离子方程式表示用CuO“除铁”时所发生的反应__,若加A调节溶液pH后溶液中Fe3+的浓度为2.0×10-9mol/L,则pH为__。
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_________________________。
(5)Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K= ________(填写计算结果);若不考虑CO32-的水解,要使46.6g BaSO4恰好完全转化为BaCO3,则至少需要浓度为1mol·L-1Na2CO3溶液 ____mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
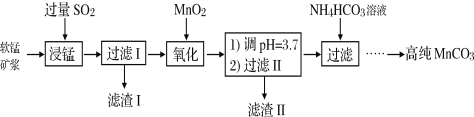
(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
ⅰ:Fe2O3+6H+ =2Fe3++3H2O
ⅱ:____________________________________________(离子方程式)。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为____________(填离子符号)。
(3)氧化过程中被MnO2氧化的物质有(写化学式):____________________。
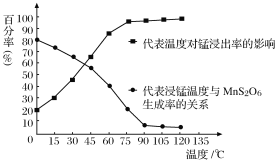
(4) “浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。
(5).加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:_______________________________________________________。
Ⅱ.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室用如图装置模拟处理含Cr2O72-废水,阳极反应式Fe-2e-=Fe2+,阴极反应式2H++2e-=H2↑随着电解进行,阴极附近pH升高。
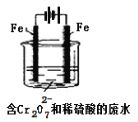
(1)电解时能否用Cu电极来代替Fe电极?____(填“能”或“不能”),理由是______________________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________________________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com