
科目: 来源: 题型:
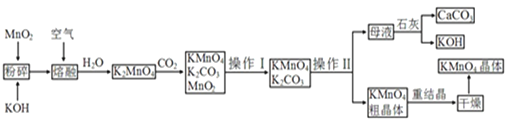
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
![]() 时溶解度
时溶解度![]() 克
克![]() 克水
克水![]() ,
,![]() :111,
:111,![]() :
:![]()
![]() 稀溶液是一种常用的消毒剂,其消毒原理与下列____物质相似。
稀溶液是一种常用的消毒剂,其消毒原理与下列____物质相似。
A ![]() 酒精
酒精 ![]() 双氧水
双氧水 ![]() 苯酚
苯酚 ![]() “84”消毒液
“84”消毒液![]() 溶液
溶液![]()
![]() 操作Ⅰ的名称是____;操作Ⅱ是根据
操作Ⅰ的名称是____;操作Ⅱ是根据![]() 和
和![]() 两物质在____
两物质在____![]() 填性质
填性质![]() 上差异,采用____
上差异,采用____![]() 填操作步骤
填操作步骤![]() 、趁热过滤得到
、趁热过滤得到![]() 粗晶体的。
粗晶体的。
![]() 上述流程中可以循环使用的物质有石灰、
上述流程中可以循环使用的物质有石灰、![]() 、____和____
、____和____![]() 写化学式
写化学式![]() 。
。
![]() 向
向![]() 溶液中通入
溶液中通入![]() 以制备
以制备![]() ,该反应中的还原剂是_________。
,该反应中的还原剂是_________。
![]() 铋酸钠
铋酸钠![]() ,不溶于水
,不溶于水![]() 用于定性检验酸性溶液中
用于定性检验酸性溶液中![]() 的存在
的存在![]() 铋元素的还原产物为
铋元素的还原产物为![]() ,Mn的氧化产物为
,Mn的氧化产物为![]() 价
价![]() ,写出反应的离子方程式_________。
,写出反应的离子方程式_________。
![]() 写出
写出![]() 、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式___________。
、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式___________。
![]() 若不考虑物质循环与制备过程中的损失,则
若不考虑物质循环与制备过程中的损失,则![]() 可制得____
可制得____![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.1 mol O2的体积是22.4 L
B.1.7 g NH3中含有的质子数约为6.02×1023
C.8 g S在足量O2中完全燃烧转移的电子数约为3.01×1023
D.0.5 mol·L1NaCl溶液中含有Cl的物质的量为0.5 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】人体血液里存在重要的酸碱平衡:![]() ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随![]() 变化关系如下表:
变化关系如下表:
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是
A. 正常人体血液中, ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B. 人体血液酸中毒时,可注射![]() 溶液缓解
溶液缓解
C. ![]() 的血液中,
的血液中, ![]()
D. pH=7.40的血液中, ![]() 的水解程度一定大于
的水解程度一定大于![]() 的电离程度
的电离程度
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯烯丹是一种播前除草剂,其合成路线如下:
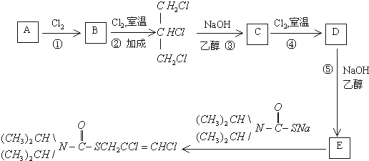
已知:D在反应![]() 中能生成的E,其结构只有一种可能.
中能生成的E,其结构只有一种可能.
![]() 写出下列反应的类型:
写出下列反应的类型:
反应![]() 是 ______ ,反应
是 ______ ,反应![]() 是 ______ .
是 ______ .
![]() 写出下列物质的结构简式:C ______
写出下列物质的结构简式:C ______
![]() 的系统命名为 ______ ,E中官能团的结构式 ______
的系统命名为 ______ ,E中官能团的结构式 ______
![]() 与NaOH水溶液反应的化学方程式 ______
与NaOH水溶液反应的化学方程式 ______
![]() 写出C的同分异构体
写出C的同分异构体![]() 核磁共振氢谱只有一种峰
核磁共振氢谱只有一种峰![]() ______
______
![]() 下列叙述正确的是 ______
下列叙述正确的是 ______
![]() 到B的反应条件为加热
到B的反应条件为加热 ![]() 到二氯烯丹的反应为加成
到二氯烯丹的反应为加成
![]() 碱性水解的产物之一分子式为
碱性水解的产物之一分子式为![]()
![]() 二氯烯丹酸性水解可生成
二氯烯丹酸性水解可生成![]() .
.
查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳生活”是指减少能源消耗、节约资源,从而减少二氧化碳排放的生活方式。下列不符合“低碳生活”的做法是( )
A.用篮子代替塑料袋 B.经常开车上班
B.经常开车上班
C.使用节能灯泡 D.节约每一滴水
D.节约每一滴水
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
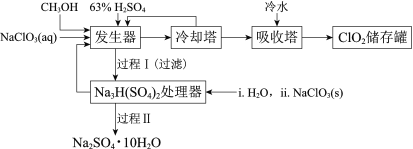
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
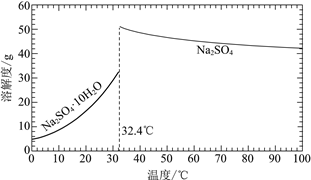
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
查看答案和解析>>
科目: 来源: 题型:
【题目】青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下:

请回答下列问题:
(l)对青蒿进行破碎的目的是__________________。
(2)操作I用到的玻璃仪器是__________,操作Ⅱ的名称是_______。
(3)用下列实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:

① 仪器各接口的连接顺序从左到右依次为_______(每个装置限用一次)。A装置中发生的化学反应方程式为_________________。
② 装置C中CuO的作用是_________________。
③ 装置D中的试剂为_________________。
④ 已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如下表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素的最简式为__________。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH 、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是______(填字母代号)。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列物质在水溶液中的水解离子方程式及沉淀溶解平衡方程式:
(1)NaClO水解离子方程式___________________________
(2)NH4Cl水解离子方程式____________________________
(3)KAl(SO4)2·12H2O水解离子方程式__________________________
(4)CaCO3沉淀溶解平衡方程式__________________________
(5)Fe(OH)3沉淀溶解平衡方程式__________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(咖啡酸)和Y(1,4
-环己二酮单乙二醇缩酮)为原料合成(如下图)。
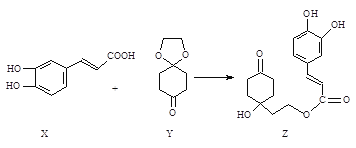
试填空:
(1)X的分子式为_______;该分子中最多共面的碳原子数为________。
(2)Y中是否含有手性碳原子_____(填“是”或“否”)。
(3)Z能发生_______反应。(填序号)
A.取代反应 B.消去反应 C.加成反应
(4)1 mol Z与足量的氢氧化钠溶液充分反应,需要消耗氢氧化钠________mol;
1 mol Z在一定条件下与足量H2充分反应,需要消耗H2 ________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.用标准溶液润洗滴定管2~3次;
B.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.调节液面至“0”或“0”以下刻度,记下读数;
E.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
就此实验完成填空:根据上述数据,可计算出该盐酸的浓度约为__________(保留两位有效数字)
II.亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如下:

(1)碘标准液应选用____(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行_____、洗涤、____。
(2)锥形瓶内的指示剂为_____,判断达到滴定终点的现象是______________________。
(3)下列操作会使测定结果偏大的有_______
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品w g,按乙方案测得消耗0.01000mol·L-1 I2溶液VmL,则1kg样品中含SO2的质量是____g(用含w、V的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com