
科目: 来源: 题型:
【题目】已知断裂 1 mol 共价键所需要吸收的能量分别为 H-H 键:436 kJ;I-I 键:153 kJ;H-I 键:299 kJ。下列对反应 H2(g)+I2(g)2HI(g)的判断中,错误的是( )
A.该反应是放出能量的反应B.该反应是吸收能量的反应
C.该反应是氧化还原反应D.I2 与 H2 具有的总能量大于生成的 HI 具有的总能量
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将0.1000mol·L-1的AgNO3标准溶液分别滴加到20mL浓度均为0.1000mol·L-1的NaCl和NaBr溶液中,混合溶液的pAg [-lgc(Ag+)]与滴定百分数(滴定所用标准溶液体积相对于滴定终点时所用标准溶液体积的百分数)的变化关系如图所示。下列叙述错误的是
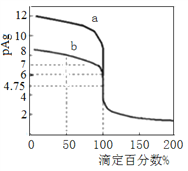
A. 曲线a代表滴定NaBr溶液
B. Ksp(AgCl) =1×10-9.5
C. 滴定至50%时,NaCl溶液中c(Na+) >c(NO3-)>c(Ag+)>c(H+)
D. 滴定至100%时,c(H+) +c(Ag+) = c(Br-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某温度(t ℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw=______。在此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,若所得混合液为中性,且a+b=12,则Va∶Vb=________。
(2)25 ℃时,0.1 mol·L-1的HA溶液中![]() =1010。请回答下列问题:
=1010。请回答下列问题:
①HA是________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是__________(填字母)。
a.c(HA) b.![]() c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.向稀醋酸溶液中加入少量醋酸钠固体,醋酸的电离程度增大
B.电镀时,通常把待镀金属制品作阳极,镀层金属作阴极
C.常温下,2NO2(g)=2NO(g)+O2(g)不能自发进行,则该反应的ΔH>0
D.工业通过反应“Na(l)+KCl(l)![]() NaCl(l)+K(g)”冶炼钾、说明钠的金属性强于钾
NaCl(l)+K(g)”冶炼钾、说明钠的金属性强于钾
查看答案和解析>>
科目: 来源: 题型:
【题目】已知该反应4NH3+5O2=4NO+6H2O中,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是
A.![]() v(NH3)=v(O2)B.
v(NH3)=v(O2)B.![]() v(O2)=v(H2O)
v(O2)=v(H2O)
C.![]() v(NH3)=v(H2O)D.
v(NH3)=v(H2O)D.![]() v(O2)=v(NO)
v(O2)=v(NO)
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度T1时,Ag2SO4在水中的沉淀溶解曲线如图实线所示。下列说法正确的是( )

A. T1时,Ag2SO4的溶度积常数(Ksp)为1×10-3
B. T1时,0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合不会生成沉淀
C. b点表示T1时Ag2SO4的饱和溶液,稀释时可以使溶液由b点变到a点
D. 仅通过降温的方法,可以使T2时的饱和溶液从c点变到T1时b点
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂漂白剂,主要用于纸浆漂白、水处理等;工业上生产NaClO2有多种方法,某工业生产的流程如图所示:
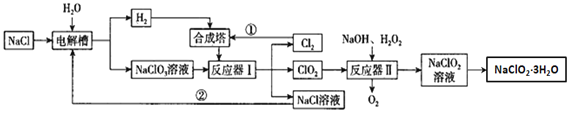
请回答下列问题:
(1)合成塔中生成的物质是___(填化学式);
(2)电解槽中阳极上的电极反应式为___;
(3)反应器Ⅰ中发生反应的化学方程式为___;反应器Ⅱ中发生的反应中氧化剂与还原剂物质的量之比为___;
(4)流程中①、②在工业生产中的现实意义是___;
(5)从NaClO2溶液中得到NaClO2·3H2O粗晶体的步骤为___、___,过滤、洗涤干燥;
(6)为了测定NaClO2·3H2O的纯度,取上述合成产品10g溶于水配成500mL溶液,取出10mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.264mol/LNa2S2O3标准液滴定,锥形瓶中溶液___(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.00mL,试样纯度是否合格___(填“合格”或“不合格”,合格纯度在90%以上)。提示:2Na2S2O3+I2=Na2S4O6+2NaI。
查看答案和解析>>
科目: 来源: 题型:
【题目】图中C%表示某反应物在体系中的百分含量,v表示反应速率,p表示压强,t表示反应时间,图(A)为温度一定时压强与反应速率的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是( )
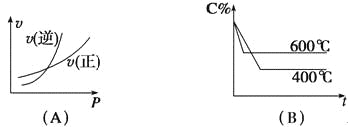
A.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-808.7 kJ/mol
4NO(g)+6H2O(g) △H=-808.7 kJ/mol
B.N2O3(g)![]() NO2(g)+NO(g) △H=+41.8 kJ/mol
NO2(g)+NO(g) △H=+41.8 kJ/mol
C.3NO2(g)+H2O(l)![]() 2HNO3(l)+NO(g) △H=-261.3 kJ/mol
2HNO3(l)+NO(g) △H=-261.3 kJ/mol
D.CO2(g)+C(s)![]() 2CO(g) △H=+171.4kJ/mol
2CO(g) △H=+171.4kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】含铁化合物在生活生产中应用广泛。如高铁酸盐(FeO42-)被科学家们公认为绿色消毒剂,在强碱性溶液中比较稳定;聚合硫酸铁则是一种高效絮凝剂。
(1)KClO与Fe(NO3)3饱和溶液反应可制备K2FeO4,两种溶液的混合方式为____。
A.在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO饱和溶液中
B.在搅拌下,将KClO饱和溶液缓慢滴加到Fe(NO3)3饱和溶液中
C.在搅拌下,将KClO饱和溶液和Fe(NO3)3饱和溶液一起加入
反应的离子方程式为______________________________。
(2)高铁酸盐有极强的氧化性,能迅速有效地去除淤泥中的臭味物质,自身被还原成新生态的Fe(OH)3。已知Ksp[Fe(OH)3]=1.0×10-38。若要使溶液中Fe3+沉淀完全(使其浓度小于10-5 mol·L-1),需调节溶液的pH>____。
(3)聚合硫酸铁[Fex(OH)y(SO4)z]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁配成100.00 mL溶液A;
②准确量取20.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65g;
③准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
④准确量取25.00 mL溶液B,用0.100 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。
通过计算确定该聚合硫酸铁的化学式(写出计算过程)______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 用牺牲阳极的阴极保护法保护船舶时,将船舶与石墨相连
B. 往含硫酸的淀粉水解液中,先加氢氧化钠溶液,再加碘水,检验淀粉是否水解完全
C. 反应3Si(s)+2N2(g)=Si3N4(s)能自发进行,则该反应的△H<0
D. 已知BaSO4的Ksp= (Ba2+ )·c(SO42-),所以BaSO4在硫酸钠溶液中溶解达到饱和时有c(Ba2+)=c(SO42-)=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com