
科目: 来源: 题型:
【题目】某无色溶液,经测定含有Al3+、Br-、SO42-,且各离子物质的量浓度相等(不考虑水电离出来的H+和OH-),则对该溶液的说法合理的是( )
A.可能含有![]() B.可能含有
B.可能含有![]() C.一定含有
C.一定含有![]() D.至少含有四种离子
D.至少含有四种离子
查看答案和解析>>
科目: 来源: 题型:
【题目】用酸性氢氧燃料电池电解粗盐水(含Na+、Cl-和少量Mg2+、Br-)的装置如图所示(a、b均为石墨电极),下列说法正确的是
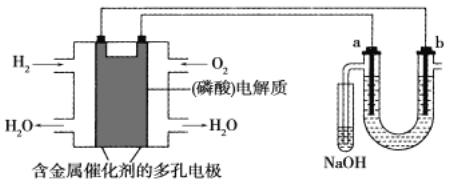
A.电池工作时,负极反应式为:H2-2e-+2OH-=2H2O
B.当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.1 mol气体
C.电解过程中电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.a极的电极反应式为:2H++2e-=H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液:NH![]() 、Cu2+、NO
、Cu2+、NO![]() 、SO
、SO![]()
B.能使紫色石蕊试液变红的溶液:Al3+、Fe3+、NO![]() 、Cl-
、Cl-
C.滴加KSCN溶液显红色的溶液:Ba2+、K+、Cl-、OH-
D.与铝反应产生大量氢气的溶液:Na+、Mg2+、CO![]() 、NO
、NO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中的硫的回收:SO2(g)+2CO(g)![]() 2CO2(g)+S(l) ΔH<0。一定温度下,在容积为2L的恒容密闭容器中,1molSO2和nmolCO发生反应,2min后达到平衡,生成2amolCO2。下列说法中正确的是( )
2CO2(g)+S(l) ΔH<0。一定温度下,在容积为2L的恒容密闭容器中,1molSO2和nmolCO发生反应,2min后达到平衡,生成2amolCO2。下列说法中正确的是( )
A.反应前2min的平均速率υ(SO2)=0.1amol/(L·min)
B.当混合气体的物质的量不再改变时,反应达到平衡状态
C.平衡后保持其他条件不变,从容器中分离出部分硫,平衡向正反应方向移动
D.平衡后保持其他条件不变,升高温度和加入催化剂,SO2的转化率均增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.用醋酸溶解大理石:CaCO3+2H+=Ca2++H2O+CO2↑
B.向氨水中通入足量SO2气体:SO2+NH3·H2O=NH![]() +HSO
+HSO![]()
C.FeO溶于稀硝酸:FeO+2H+=Fe2++H2O
D.电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验、实验现象和相应结论都正确的是
实验 | 现象 | 结论 | |
A | 向1mL | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】某试液中只可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子,离子浓度均为
中的若干种离子,离子浓度均为![]() 某同学进行了如下实验:下列说法正确的是
某同学进行了如下实验:下列说法正确的是![]()
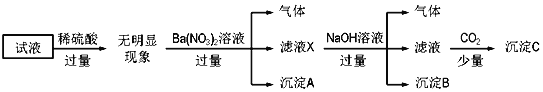
A.无法确定原试液中是否含有![]()
B.滤液X中大量存在的阳离子有![]() 、
、![]() 和
和![]()
C.沉淀C为Al![]()
D.原试液中一定不含有![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
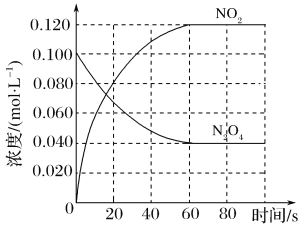
该反应ΔH______0(填“>”、“<”或“=”),在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1。平衡常数K=________________(请书写单位)。在温度不变的情况下向平衡体系中再充入N2O4 0.01mol·L-1和NO20.03mol·L-1此时v(正)___________v(逆)(填“>”、“<”或“=”)。有利于提高反应N2O4(g) ![]() 2NO2(g)平衡转化率的条件是________(填标号)。
2NO2(g)平衡转化率的条件是________(填标号)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
(2)在一定温度下,向a L密闭容器中加入1 molN2O4(g)发生如下反应:N2O4(g) ![]() 2NO2(g),不能说明该反应一定达平衡的是__________。
2NO2(g),不能说明该反应一定达平衡的是__________。
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内O2、NO、NO2的浓度之比为1:2:2
D.单位时间内生成1 mol N2O4(g),同时生成2 mol NO2
E.混合气体的密度不随时间变化
F.混合气体的颜色不随时间变化
(3)在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则如图所示符合客观事实的是__________
A. 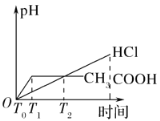 B.
B. 
C. 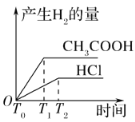 D.
D. 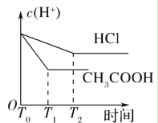
(4)25 ℃时,一元弱酸HA溶液Kal=4.3×10-4 ,一元弱酸HB溶液Ka2=5.6×10-4则酸性HA____________HB(填“>”、“<”或“=”)。
(5)常温下0.001mol·L-1的H2SO4溶液与0.004mol·L-1的NaOH溶液1:1体积比混合,混合后溶液的pH=_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,10L0.40mol/L的![]() 溶液发生催化分解,不同时刻测得生成
溶液发生催化分解,不同时刻测得生成![]() 的体积(已折算为标准状况下)如表所示:
的体积(已折算为标准状况下)如表所示:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列说法不正确的是(溶液体积变化忽略不计)( )
A.0~4min内的平均反应速率![]()
B.6~10min内的平均反应速率![]()
C.反应至6min时,![]()
D.反应至6min时,![]() 分解了50%
分解了50%
查看答案和解析>>
科目: 来源: 题型:
【题目】相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
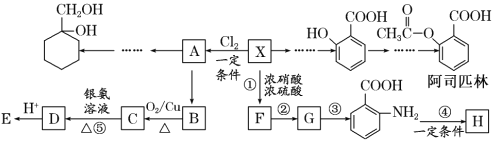
已知:Ⅰ.![]()
Ⅱ.![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)X→A的反应条件是____。
(2)H的结构简式是____。
(3)反应③④的类型是____、____。
(4)反应⑤的化学方程式是____。
(5)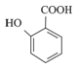 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有___种。
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有___种。
(6)请用合成反应流程图表示出由![]() 和其他无机物合成
和其他无机物合成![]() 的最合理的方案(不超过4步)__________。
的最合理的方案(不超过4步)__________。
例如:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com