
科目: 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是![]()
A.白磷![]() 为正四面体结构,则
为正四面体结构,则![]() 与
与![]() 所含共价键数目之比为3:1
所含共价键数目之比为3:1
B.1mol乙酸与足量的![]() 充分发生酯化反应可生成
充分发生酯化反应可生成![]() 分子
分子![]() 个
个
C.![]() 与
与![]() 的混合物中所含中子数为
的混合物中所含中子数为![]()
D.浓度均为![]() 的醋酸和醋酸钠溶液等体积混合,溶液中
的醋酸和醋酸钠溶液等体积混合,溶液中![]() 和
和![]() 的总数为
的总数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请回答下列问题:
(1)观察图,标准液盐酸应放入__滴定管中。(填“甲”或“乙”)

(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视__,滴定终点的现象为__。
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为__mL,所用盐酸溶液的体积为___mL。
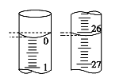
(4)某学生根据3次实验分别记录有关数据如表所示:
滴定次数 | 待测NaOH溶液的体积 | 0.1000mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据表中数据计算该NaOH溶液的物质的量浓度__。
(5)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__(填字母序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.乙酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O
B.醋酸溶液与氢氧化铜反应:2CH3COOH+Cu(OH)2![]() Cu2++2CH3COO-+2H2O
Cu2++2CH3COO-+2H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O![]() 2C6H5OH+CO32-
2C6H5OH+CO32-
D.甲酸溶液与足量的银氨溶液共热:HCOOH+4[Ag(NH3)2]++4OH-![]() CO32-+2NH4++4Ag↓+6NH3+2H2O
CO32-+2NH4++4Ag↓+6NH3+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、天平、药匙、______、______。
(2)写出Na2SO3固体氧化变质的化学方程式__________。
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是________,在过滤前,需要检验是否沉淀完全,其操作是_______。
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果_______(填“偏高”或“偏低”)。
(5)若操作正确,结果为m1<m2,试分析原因是___________。
(6)取25.00 mL上述溶液,用c mol/L酸性KMnO4溶液滴定测定Na2SO3的纯度,已知酸性条件下,KMnO4通常被还原为Mn2+,滴定达到终点时的现象为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是25 ℃时某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)H2C2O4与含等物质的量的KOH的溶液反应后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为_______________________________________。
(2)向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
(3)向碳酸钠溶液中滴加少量氯水的离子方程式为_____________________。
(4)若0.1mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则c(Na+)-c(CH3COO-)=_______________mol·L-1(填精确计算结果)。
(5) 将CH3COOH溶液与大理石反应所产生的标况下44.8L气体全部通入到2L 1.5mol/L的NaOH溶液中充分反应,则溶液中所有离子的物质的量浓度由大到小的顺序为__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题:
(1)某温度时,测得0.01mol/L的NaOH溶液pH=13,该温度下水的Kw=__。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25.0kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-48.0kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:__。
(3)已知25℃时Ksp(Mg(OH)2)=1.8×10-11,为除去某食盐溶液中的Mg2+,可用NaOH为除杂试剂,当控制溶液pH=12时,可确保Mg2+除尽,此时溶液中Mg2+的物质的量浓度为__mol/L。
(4)生活中明矾常作净水剂,其净水的原理是__(用离子方程式表示)。
(5)常温下,取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合,测得混合溶液后的pH=5,写出MOH的电离方程式:__。
(6)0.1mol/L的NaHA溶液中,已知有关粒子浓度由大到小的顺序为:c(Na+)>c(HA-)>c(H2A)>c(A2-)
①该溶液中c(H+)__c(OH-)(填“>”、“<”或“=”)
②作出上述判断的依据是__(用文字解释)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)基态氧原子的价层电子排布式不能表示为2s22px22py2,因为这违背了___________原理或规则。
(2)基态Cu原子核外电子排布式为_______,则高温下的稳定性CuO _____ Cu2O(填“>”或“<”)。
(3)在尿素CO(NH2)2中C、N的杂化方式分别为________,OF2的空间构型是___________。
(4)在Fe(NO3)3溶液中加入Na2SO3,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。又变为棕黄色的原因是_____(用离子方程式表示)。
(5)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,写出氨硼烷的结构式_____,并写出一种与氨硼烷互为等电子体的分子______(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是( )
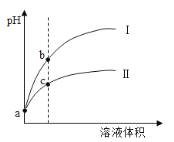
A.曲线I为次氯酸稀释时pH变化曲线
B.b点溶液中水的电离程度比c点溶液中水的电离程度小
C.a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D.取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
查看答案和解析>>
科目: 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )


A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com