
科目: 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.溴水中有平衡:Br2+H2O![]() HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅
B.对CO(g) + NO2 (g)![]() CO2(g)+ NO(g) 平衡体系增大压强可使颜色变深
CO2(g)+ NO(g) 平衡体系增大压强可使颜色变深
C.高压比常压有利于合成SO3的反应
D.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作能达到实验目的的是()
实验目的 | 实验操作 | |
A | 除去MgCl2溶液中的少量FeCl3 | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后,过滤 |
B | 验证乙醇和浓硫酸可以制备乙烯 | 乙醇和浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 |
C | 比较HClO和CH3COOH酸性 | 用pH试纸测定浓度均为0.1mol/L的HClO溶液和CH3COOH溶液的pH |
D | Mg(OH)2可溶解于饱和NH4Cl溶液 | 将NH4Cl固体与Mg(OH)2混合 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是( )

A.盐酸的浓度越大,腐蚀速率越快
B.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
C.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
D.对比盐酸和硫酸两条曲线,可知Cl-也可能会影响碳素钢的腐蚀速率
查看答案和解析>>
科目: 来源: 题型:
【题目】对H2O2的分解速率影响因素进行研究。在相同温度下,实验测得不同条件下出O2浓度随时间变化如图所示。下列说法不正确的是( )
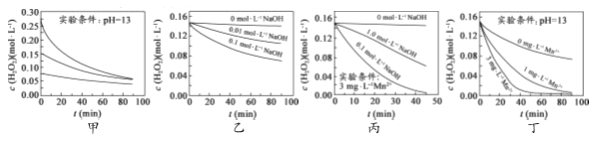
A. 图甲表明,可通过适当增大H2O2浓度,加快H2O2分解速率
B. 图乙表明,可通过调节溶液的酸碱性,控制H2O2分解速率快慢
C. 图丙表明,Mn2+少量存在时,碱性太强,不利于H2O2分解
D. 图乙、图丙和图丁表明,Mn2+是H2O2分解的催化剂,提高Mn2+的浓度就能增大H2O2 分解速率
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH![]() +6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
+6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①滴定时边滴边摇动锥形瓶,眼睛应观察___。
②达到滴定终点的标志是___。
③以下操作造成测得样品中氮的质量分数偏高的原因可能是___。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,水未倒尽
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010mol/L,则该样品中氮的质量分数为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学中常用图象直观地描述化学反应的进程或结果(图④纵坐标表示难溶物达到饱和时的浓度)。下列对图象描述正确的是

A.根据图①可判断可逆反应A2(g) +3B2(g)![]() 2AB3(g)的△H>0
2AB3(g)的△H>0
B.图②可表示压强对可逆反应2A(g) +2B(g)![]() 3C (g) + D(s)的影响,乙的压强大
3C (g) + D(s)的影响,乙的压强大
C.图③可表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中用下列装置测定SO2催化氧化为SO3的转化率(部分夹持装置已省略,已知SO3的熔点为16.8℃,假设气体进入装置时均被完全吸收,且忽略空气中CO2的影响),下列说法不正确的是( )
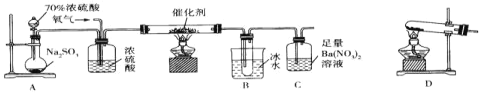
A.A装置烧瓶中发生的反应可以表示为SO32-+2H+=SO2↑+H2O
B.用D装置制备氧气,试管中的药品可以是KClO3
C.当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气
D.C中产生的白色沉淀是BaSO4
查看答案和解析>>
科目: 来源: 题型:
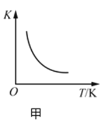
【题目】根据下列图示所得出的结论正确的是
A.图甲表示反应![]() 的平衡常数K与温度的关系,说明该反应的
的平衡常数K与温度的关系,说明该反应的![]()
B.图乙表示Cu与过量浓硝酸反应生成的![]() 气体体积随时间的变化关系,说明该反应在
气体体积随时间的变化关系,说明该反应在![]() 时间段内反应速率最快
时间段内反应速率最快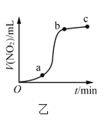
C.图丙表示一定温度下![]() 和NiS的沉淀溶解平衡曲线,说明该温度下,
和NiS的沉淀溶解平衡曲线,说明该温度下,![]() 时,两者的
时,两者的![]() 相等
相等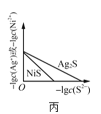
D.图丁表示相同温度下,![]() 的HF和
的HF和![]() 溶液分别加水稀释时pH的变化曲线,说明加水稀释前HF的电离程度大于
溶液分别加水稀释时pH的变化曲线,说明加水稀释前HF的电离程度大于![]() 的电离程度
的电离程度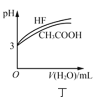
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)写出H2CO3电离方程式_________平衡常数表达式Ka1(H2CO3)=__________________
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________
(3)①CH3COO-、②HCO3-、③CO32-、④ClO-结合H+的能力由强到弱的顺序为(注意:用序号①、②、③、④作答)____________________
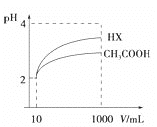
(4)体积为10mLpH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数。
(5)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】利用NO、O2和Na2CO3溶液反应制备NaNO2的装置如图所示,下列关于该装置的描述不正确的是( )
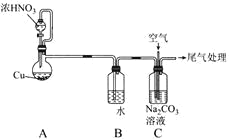
A.装置A分液漏斗中的药品选用不当,应选用稀HNO3
B.实验过程中,通过控制分液漏斗的活塞控制气流速度
C.装置C中发生反应的化学方程式为2Na2CO3+4NO+O2=4NaNO2+2CO2↑
D.实验过程中,装置C液面上方可能出现红棕色气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com