
科目: 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。Q点时欲使溶液恢复到起始状态,可向溶液中加入
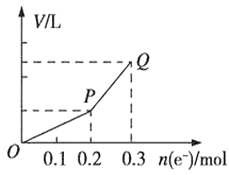
A. 0.1 mol CuO
B. 0.1 mol CuCO3
C. 0.1 mol Cu(OH)2
D. 0.05 mol Cu2(OH)2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】150℃时,将1L混合烃与9L氧气混合没在密闭容器内充分燃烧,当恢复至150℃,体积恒定时,容器内压强增大8%,则该混合烃的组成是
A.甲烷与乙烷的体积比是1∶4B.丙炔与乙炔的体积比是1∶4
C.乙烯与丁烷的体积比是1∶4D.乙烯与丁烯的体积比是1∶4
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应Fe(s)+ CO2(g)![]() FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
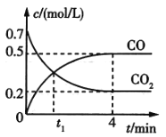
(1)t1min时,正、逆反应速率的大小关系为v正__v逆(填“>”“<”或“=”).
(2)0~4min内,CO2的转化率为__,CO的平均反应速率,v(CO)=__。
(3)下列条件的改变能减慢上述反应的反应速率的是__(填序号,下同)。
①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大 ④保持体积不变,充入He使体系压强增大
(4)下列选项能说明上述反应已达平衡状态的是__。
①v(CO2)=v(CO)
②单位时间内生成nmolCO2的同时生成nmolCO
③容器中气体压强不随时间的变化而变化
④容器中气体的平均相对分子质量不随时间的变化而变化
查看答案和解析>>
科目: 来源: 题型:
【题目】一种新型可逆电池的工作原理如下图所示。放电时总反应为:Al+3Cn(AlCl4)+4AlCl4-![]() 4Al2Cl7-+3Cn(Cn表示石墨)。
4Al2Cl7-+3Cn(Cn表示石墨)。

下列说法正确的是
A. 放电时负极反应为:2Al-6e-+7Cl-= Al2Cl7-
B. 放电时AlCl4-移向正极
C. 充电时阳极反应为: AlCl4-e-+Cn=Cn(AlCl4)
D. 电路中每转移3mol电子,最多有1molCn(AlCl4)被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】4Na2SO42H2O2NaCl又称固体双氧水,具有漂白、杀菌、消毒作用,又由于其稳定性比过碳酸钠(2Na2CO33H2O2)固体更好,因而具有广泛的应用前景。某小组合成该固体双氧水的实验步骤和装置示意图如下:
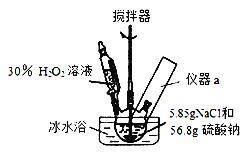
Ⅰ.合成:往三颈瓶中加入56.8g硫酸钠和5.85gNaCl的固体混合物,开启搅拌器;将稍过量的(约70mL)30%H2O2溶液在20~30min内逐滴分批加入。并控制反应温度15~35℃,加完料后持续搅拌15min,反应结束后过滤,低温干燥得到产品。
Ⅱ.产品稳定性取Ⅰ中所得产品置于干燥器内保存一个月,并分别在放置前、放置后取一定质量的样品溶于水,加适量稀硫酸酸化,用0.1000mol/L酸性高锰酸钾滴定,测定产品中双氧水的含量,以此分析产品的稳定性.所得实验数据如下表:
数据 时间 | 样品取用数量(g) | 平均V(KMnO4)/mL |
放置前测定 | a | 25.00 |
放置一个月后测定 | a | 24.90 |
已知:a.H2O2不稳定,加热,加入某些金属离子或加碱均有利于其分解
b.产品稳定性=![]() ×100%
×100%
请回答下列问题:
(1)装置图里方框中应添加仪器a,其名称为_______________________;写出合成4Na2SO42H2O2NaCl的化学方程式:_____________________________。
(2)该合成反应过程中,关键是控制温度,其合理的措施是:______________。
A.逐滴滴加H2O2 B.选用Na2SO4和NaCl固体,而不用其饱和溶液
C.不断搅拌 D.冰水浴
(3)该合成反应过程中30%的H2O2溶液不应大大过量的原因________________。
(4)4Na2SO42H2O2NaCl固体比过碳酸钠(2Na2CO33H2O2)固体更稳定的可能原因是__________。
(5)产品分析实验时,高锰酸钾溶液装于滴定管中,当滴定到达终点时的现象是_________________。下列关于该滴定实验过程中的仪器选择和操作都正确的是_____________
A. B.
B. C.
C. D.
D.
(6)该产品的“产品稳定性”=___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】沙罗特美是一种长效平喘药,其合成的部分路线如下:
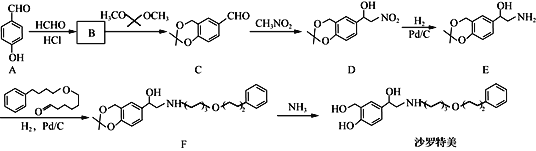
(1)F中的含氧官能团名称为____________。
(2)A的名称为____________。
(3)D→E的反应类型为____________,沙罗特美的分子式为____________。
(4)B的分子式为C8H8O3,与(CH3)2C(OCH3)2发生取代反应得到物质C和CH3OH,写出B的结构简式:____________________。
(5)判断同时满足下列条件的C的同分异构体的数目:_______。(不考虑立体异构)
①分子中含有![]() 结构且只有一个环状结构,与FeCl3发生显色反应;
结构且只有一个环状结构,与FeCl3发生显色反应;
②能与NaHCO3发生反应放出CO2。
③苯环上有且只有三个取代基
(6)请写出以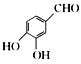 、(CH3)2C(OCH3)2、CH3NO2为原料制备
、(CH3)2C(OCH3)2、CH3NO2为原料制备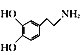 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】t℃时,AgX(X=Cl、Br)的溶度积与c(Ag+)和c(X-)的相互关系如下图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是( )

A. c点可表示AgCl的不饱和溶液
B. b点的AgCl溶液加入AgNO3晶体可以变成a点
C. t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K=10-4
AgBr(s)+Cl-(aq)平衡常数K=10-4
D. t℃时,取a点的AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,![]() 分子中含有
分子中含有![]()
![]() 个碳氧双键
个碳氧双键
B.一定温度下,![]() 完全反应转移的电子数一定为
完全反应转移的电子数一定为![]()
![]()
C.常温常压下,![]() 固体中离子总数为
固体中离子总数为![]()
![]()
D.常温常压下,![]() 溶液中
溶液中![]() 和
和![]() 数目之和为
数目之和为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,已知下列三种金属硫化物的溶度积常数(Ksp)分别为:Ksp(FeS)=6.3×10-18 ;Ksp(CuS)=1.3×10-36 ;Ksp(ZnS)=1.6×10-24 。下列关于常温时的有关叙述正确的是( )
A. 硫化锌、硫化铜、硫化亚铁的溶解度依次增大
B. 将足量的ZnSO4晶体加入到0.1 mol·L-1的Na2S溶液中,Zn2+的浓度最大只能达到1.6×10-23 mol·L-1
C. 除去工业废水中含有的Cu2+,可采用FeS固体作为沉淀剂
D. 向饱和的FeS溶液中加入FeSO4溶液后,混合液中c(Fe2+)、Ksp(FeS)都变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com