
科目: 来源: 题型:
【题目】铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:
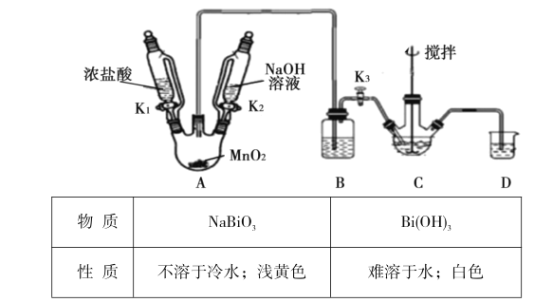
(1)C中盛放Bi(OH)3与NaOH的混合物,与Cl2反应生成NaBiO3,反应的化学方程式为__。B装置的作用是__。
(2)当观察到__(填现象)时,可以初步判断C中反应已经完成。
(3)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭__;打开__。
(4)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有_。
Ⅱ.铋酸钠的应用——检验Mn2+
(5)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+。产生紫红色现象的离子方程式为__。
Ⅲ.产品纯度的测定
(6)取上述NaBiO3产品ag,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用bmo1L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4-—CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗cmL标准溶液。该产品的纯度为__(用含a、b、c的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】由A(芳香烃)与E为原料制备J和高聚物G的一种合成路线如下:
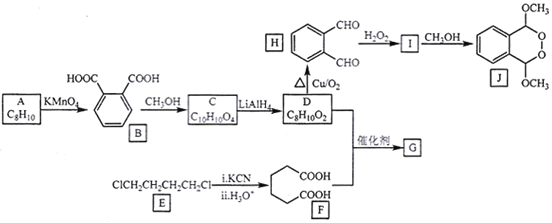
已知:①酯能被LiAlH4还原为醇
②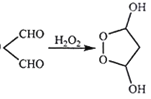
回答下列问题:
(1)A的化学名称是___________,J的分子式为__________,H的官能团名称为___________。
(2)由I生成J的反应类型为___________。
(3)写出F+D→G的化学方程式:______________________。
(4)芳香化合物M是B的同分异构体,符合下列要求的M有______种,写出其中2种M的结构简式:______________。
①1mol M与足量银氨溶液反应生成4 mol Ag
②遇氯化铁溶液显色
③核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比1:1:1
(5)参照上述合成路线,写出用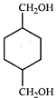 为原料制备化合物
为原料制备化合物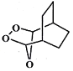 的合成路线(其他试剂任选)。____________________________________________________。
的合成路线(其他试剂任选)。____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )

A. 由图甲知,B点SO2的平衡浓度为0.3mol·L-1
B. 由图甲知,A点对应温度下的平衡常数为80
C. 达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示
D. 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是 ( )

A.该硫酸的物质的量浓度为9.2 mol·L-1
B.1 mol Zn与足量的该硫酸反应,标准状况下产生22.4 L气体时,转移的电子数为NA
C.配制200 mL 4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合后所得溶液的物质的量浓度等于9.2 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】把500![]() 有
有![]() 和
和![]() 的混合溶液分成5等份,取一份加入含
的混合溶液分成5等份,取一份加入含![]()
![]() 硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含
硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含![]()
![]() 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】利用催化技术可将汽车尾气中的NO和CO转变成![]() 和
和![]() ,化学方程式如下:
,化学方程式如下:![]() 某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:下列说法中,不正确的是
某温度下,在容积不变的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如下表:下列说法中,不正确的是
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A.2s内的平均反应速率![]()
B.在该温度下,反应的平衡常数![]()
C.若将NO和CO的起始投料量均加倍,则平衡时NO转化率小于![]()
D.使用催化剂可以提高单位时间CO和NO的处理量
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
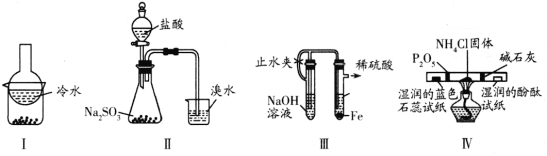
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目: 来源: 题型:
【题目】(1).将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g) ![]() H2(g)+I2(g) △H<0
H2(g)+I2(g) △H<0
①该反应平衡常数的表达式为K=__________。
②当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为________,HI的分解率为_________。
(2)在一定条件下,A气体与B气体反应生成C气体,反应过程中,反应物与生成物的浓度随时间变化的曲线如图,则
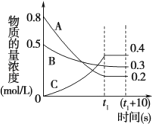
①该反应的化学方程式为:______________
②t1 s时反应物A的转化率为:__________
③0~t1 s内A的反应速率为v(A)=______。
查看答案和解析>>
科目: 来源: 题型:
【题目】设![]() 表示阿伏伽德罗常数的值,下列说法正确的是( )
表示阿伏伽德罗常数的值,下列说法正确的是( )
A.![]() 氢气中含有氢原子的数目为
氢气中含有氢原子的数目为![]()
B.标准状况下,![]() 苯中含有苯分子的数目为
苯中含有苯分子的数目为![]()
C.![]() 溶液中含有氯离子的数目为
溶液中含有氯离子的数目为![]()
D.![]() 与足量水反应,转移的电子数为
与足量水反应,转移的电子数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂,常温下为橙黄色固体,熔点:38.3℃,沸点233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2 +C+ 2Br2 ![]() TiBr4+CO2来制备TiBr4,装置如图所示。下列说法错误的是
TiBr4+CO2来制备TiBr4,装置如图所示。下列说法错误的是
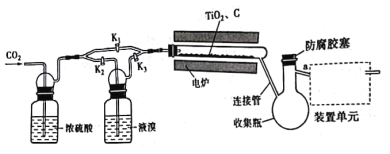
A.开始反应时,活塞的状态为K1关闭,K2,K3打开
B.为防止连接管堵塞,反应过程中需微热连接管
C.为达到实验目的,a应连接盛有NaOH溶液的洗气装置
D.反应结束后继续通入CO2排出装置中残留的四溴化钛及溴蒸气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com